题目内容
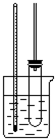
11.如图1装置常用于实验室制备气体
(1)写出实验室用该装置制备O2化学方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑或2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.
(2)若利用该装置制备干燥NH3,试管中放置药品是NH4Cl、Ca(OH)2(填化学式);仪器 a中放置药品名称是碱石灰.
(3)图2装置实验室可用于制备常见的有机气体是乙炔.仪器b名称是分液漏斗.有学生利用图B装置用浓氨水和生石灰制备NH3,请说明该方法制取NH3的原因生石灰与氨水中的水反应发出大量的热促使氨水分解生成NH3
(4)学生甲按图3所示探究氨催化氧化,用一只锥形瓶倒扣在浓氨水试剂瓶口收集氨气,然后将红热的螺旋状铜丝插入锥形瓶中;片刻,锥形瓶中气体变为红棕色.下列叙述正确的是BD
A.如图收集氨气是利用氨水的密度较小 B.锥形瓶必须干燥
C.收集氨气时间越长,红棕色现象越明显 D.铜丝能保持红热
(5)学生乙对学生甲的实验提出了异议,认为实验中产生的红棕色气体可能是空气中的氮气氧化后造成的,你认为学生乙的说法合理吗?请你设计一个简单实验证明学生乙的说法是否正确.现另取一个锥形瓶,将红热的螺旋状铜丝插入锥形瓶中观察象,如果无现象,说明乙不合理,若出现红棕色气体,说明乙的说法合理.
分析 (1)该装置为固体加热制取氧气,因此可加热高锰酸钾或加热氯酸钾和二氧化锰的混合物;
(2)实验室装置为固+固$\stackrel{△}{→}$气,可利用NH4Cl和Ca(OH)2共热制取氨气,反应产生水,可用碱石灰干燥;
(3)图2装置为固+液→气,可用于制备常见的有机气体乙炔,仪器b分液漏斗,生石灰与氨水中的水反应发出大量的热促使氨水分解生成NH3;
(4)A.氨气极易溶于水,用一只锥形瓶倒扣在浓氨水试剂瓶口收集氨气,是为了防止倒吸;
B.氨气极易溶于水,锥形瓶必须干燥;
C.4NH3+5O2$\frac{\underline{\;催化剂\;}}{\;}$4NO+6H2O,2NO+O2=2NO2分析;
D.该反应为放热反应,铜丝能保持红热;
(5)另取一个锥形瓶,将红热的螺旋状铜丝插入锥形瓶中观察现象.如果无现象,则证明上述红棕色气体由氨催化氧化后造成,而不是空气中氮气氧化后造成.
解答 解:(1)该装置为固体加热制取氧气,可加热高锰酸钾或加热氯酸钾和二氧化锰的混合物,化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,
故答案为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑或2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑;
(2)实验室装置为固+固$\stackrel{△}{→}$气,可利用NH4Cl和Ca(OH)2共热制取氨气,化学方程式为Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O,产物中的水可用碱石灰干燥,
故答案为:NH4Cl、Ca(OH)2;碱石灰;
(3)图2装置为固+液→气,可用于制备常见的有机气体乙炔,CaC2+2H2O→Ca(OH)2+CH≡CH↑,仪器b分液漏斗,生石灰与氨水中的水反应发出大量的热,可以促使氨水分解生成NH3,
故答案为:乙炔或CH≡CH;分液漏斗;生石灰与氨水中的水反应发出大量的热促使氨水分解生成NH3;
(4)A.氨气极易溶于水,用一只锥形瓶倒扣在浓氨水试剂瓶口收集氨气,是为了防止倒吸,故A错误;
B.氨气极易溶于水,锥形瓶必须干燥,故B正确;
C.发生的反应为4NH3+5O2$\frac{\underline{\;催化剂\;}}{\;}$4NO+6H2O,2NO+O2=2NO2,收集氨气时间越长,锥形瓶中氧气浓度越低,最终生成NO2的浓度越低,颜色越浅,故C错误;
D.该反应为放热反应,铜丝能保持红热,故D正确;
故答案为:BD;
(5)现另取一个锥形瓶,将红热的螺旋状铜丝插入锥形瓶中观察象,如果无现象,则证明上述红棕色气体由氨催化氧化后造成,而不是空气中氮气氧化后造成,
如出现红棕色气体,说明乙的说法合理,
答:现另取一个锥形瓶,将红热的螺旋状铜丝插入锥形瓶中观察象. 解:(1)该装置为固体加热制取氧气,可加热高锰酸钾或加热氯酸钾和二氧化锰的混合物,化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,
故答案为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑或2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑;
(2)实验室装置为固+固$\stackrel{△}{→}$气,可利用NH4Cl和Ca(OH)2共热制取氨气,化学方程式为Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O,产物中的水可用碱石灰干燥,
故答案为:NH4Cl、Ca(OH)2;碱石灰;
(3)图2装置为固+液→气,可用于制备常见的有机气体乙炔,:CaC2+2H2O→Ca(OH)2+CH≡CH↑,仪器b分液漏斗,生石灰与氨水中的水反应发出大量的热,可以促使氨水分解生成NH3,
故答案为:乙炔或CH≡CH;分液漏斗;生石灰与氨水中的水反应发出大量的热促使氨水分解生成NH3;
(4)A.氨气极易溶于水,用一只锥形瓶倒扣在浓氨水试剂瓶口收集氨气,是为了防止倒吸,故A错误;
B.氨气极易溶于水,锥形瓶必须干燥,故B正确;
C.发生的反应为4NH3+5O2$\frac{\underline{\;催化剂\;}}{\;}$4NO+6H2O,2NO+O2=2NO2,收集氨气时间越长,锥形瓶中氧气浓度越低,最终生成NO2的浓度越低,颜色越浅,故C错误;
D.该反应为放热反应,铜丝能保持红热,故D正确;
故答案为:BD;
(5)现另取一个锥形瓶,将红热的螺旋状铜丝插入锥形瓶中观察象,如果无现象,则证明上述红棕色气体由氨催化氧化后造成,而不是空气中氮气氧化后造成,
如出现红棕色气体,说明乙的说法合理,
故答案为:现另取一个锥形瓶,将红热的螺旋状铜丝插入锥形瓶中观察象,如果无现象,说明乙不合理,若出现红棕色气体,说明乙的说法合理.
点评 本题考查了常见气体的制备方案,为高频考点,综合性较强,涉及实验装置、药品、原理、实验评价等诸多环节,难度中等.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案| X | Y | Z | |
| R | W | ||
| T |
| A. | 简单离子半径大小关系为:W>R>Z>Y | |
| B. | X有多种同素异形体,而Z不存在同素异形体 | |
| C. | R2W3可用RCl3溶液与Na2W溶液混合制取 | |
| D. | T的单质既能与盐酸反应又能与NaOH溶液反应 |
| A. | 铜片插入FeCl3溶液中:Cu+2Fe3+═Cu2++2 Fe2+ | |
| B. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 烧碱溶液中加铝片:2Al+2OH-+2H2O═2 AlO2-+3H2↑ | |
| D. | 铁粉与稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ |
| A. | 加水 | B. | 加盐酸 | C. | 加热 | D. | 加醋酸钠晶体 |
| A. | K值不变,平衡一定不移动 | B. | K值变化,平衡一定移动 | ||
| C. | 平衡移动,K值一定变化 | D. | 平衡移动,K值一定不变化 |
| A. | K+离子的结构示意图: | B. | 乙烯的比例模型: | ||
| C. | H2O2的电子式 | D. | CH4Si的结构式: |
| A. | 硫酸、纯碱、小苏打 | B. | 磷酸、熟石灰、苛性钠 | ||
| C. | 硫酸氢钠、生石灰、醋酸钠 | D. | 硫酸、烧碱、胆矾 |
 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下: