题目内容
20.将下列各组物质按酸、碱、盐分类依次排列,正确的是( )| A. | 硫酸、纯碱、小苏打 | B. | 磷酸、熟石灰、苛性钠 | ||
| C. | 硫酸氢钠、生石灰、醋酸钠 | D. | 硫酸、烧碱、胆矾 |
分析 酸是指电离时生成的阳离子全部是氢离子的化合物.
碱是指电离时生成的阴离子全部是氢氧根离子的化合物.
盐是指由金属离子和酸根离子组成的化合物,据此分析选项,
A.纯碱是碳酸钠属于盐;
B.苛性钠是氢氧化钠属于碱;
C.硫酸氢钠是盐;
D.硫酸是酸,烧碱是氢氧化钠属于碱,胆矾是硫酸铜晶体属于盐;
解答 解:A、硫酸属于酸,纯碱是碳酸钠属于盐,小苏打是碳酸氢钠属于盐.故A错误;
B、磷酸属于酸,熟石灰属于碱,苛性钠是氢氧化钠属于碱.故B错误;
C、碳酸氢钠是盐,生石灰是,碳酸氧化钙属于氧化物,醋酸钠属于盐.故C错误;
D、硫酸属于酸,烧碱是氢氧化钠属于碱,胆矾是硫酸铜晶体属于盐.故D正确;
故选D.
点评 本题考查了酸碱盐的概念,解答本题要充分理解酸碱盐的概念的含义,只有这样才能对各种物质进行正确的分类,题目较简单.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
8.将CaO2放入密闭真空容器中,反应2CaO2(s)?2CaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
| A. | 平衡常数减小 | B. | CaO量不变 | C. | 氧气压强不变 | D. | CaO2量减少 |
15.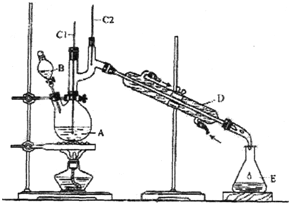 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.回答下列问题:
(1)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管;
(2)加入沸石的作用是防止暴沸;
(3)分液漏斗使用前必须进行的操作是c (填正确答案标号);
a.润湿 b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(5)反应温度应保持在90-95℃.其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化
(6)本实验中,正丁醛的产率为51%.
 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.回答下列问题:
(1)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管;
(2)加入沸石的作用是防止暴沸;
(3)分液漏斗使用前必须进行的操作是c (填正确答案标号);
a.润湿 b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(5)反应温度应保持在90-95℃.其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化
(6)本实验中,正丁醛的产率为51%.
5.有两种金属组成的混合物粉末15g与足量的稀盐酸反应,生成11.2L(标准状况下)H2,则该混合物的组成不可能是( )
| A. | Fe、Zn | B. | Al、Cu | C. | Al、Na | D. | Al、Fe |
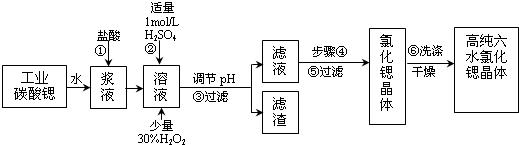
12.工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2•6H2O),其过程为:
已知:Ⅰ.有关氢氧化物沉淀的pH:
Ⅱ.SrCl2•6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
(1)操作①中碳酸锶与盐酸反应的离子方程式SrCO3+2H+=Sr2++CO2↑+H2O.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为E.
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作②中加入H2O2发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上用热风吹干六水氯化锶,适宜的温度是A.
A.50~60℃B.80~100℃C.100℃以上
(6)步骤⑥宜选用的无机洗涤剂是饱和氯化锶溶液.

已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(1)操作①中碳酸锶与盐酸反应的离子方程式SrCO3+2H+=Sr2++CO2↑+H2O.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为E.
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作②中加入H2O2发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上用热风吹干六水氯化锶,适宜的温度是A.
A.50~60℃B.80~100℃C.100℃以上
(6)步骤⑥宜选用的无机洗涤剂是饱和氯化锶溶液.
9.下列分子或离子中,含有孤电子对最多的是( )
| A. | H2S | B. | BeCl2 | C. | H3O+ | D. | NH${\;}_{4}^{+}$ |
10.环境问题是当今社会大家关注的重大问题.下列因果关系错误的是( )
| A. | 粉尘较多的环境--易患(诱发)肺病 | |
| B. | NO2和SO2排入大气中--导致酸雨 | |
| C. | 汽车尾气(含氮的氧化物等)--造成光化学烟雾 | |
| D. | 滥用化肥及含磷洗衣粉--重金属元素污染水土 |
