题目内容
7.将6.5g锌投入100ml2mol/L的稀硫酸(已知溶液密度为1.12g/cm3)中充分反应.试计算(1)产生的氢气在标准状况下的体积.
(2)反应后所得溶液的质量.
(3)现有2mol/L的稀盐酸和稀硫酸各100ml,分别加入等质量的铁,反应后生成的气体在标准状况下的体积比为2:3,求加入铁的质量.
分析 (1)据Zn+H2SO4=ZnSO4+H2↑,进行计算;
(2)利用差量法计算,溶液减少的质量即为氢气的质量;
(3)发生反应为:Fe+2HCl═FeCl2+H2↑①、Fe+H2SO4═FeSO4+H2↑②,加入铁粉质量相等,如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,而实际气体体积之比为2:3,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量.通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,可以算出来生成H2为0.1mol,根据体积比可算出来②反应生成H2为0.15mol,对于②反应是Fe不足,以此计算铁的质量.
解答 解:(1)n(H2SO4)=0.1L×2mol/L=0.2mol,n(Zn)=$\frac{6.5g}{65g/mol}$=0.1mol,注意在计算时以不足的作为计算对象,
Zn+H2SO4=ZnSO4+H2↑
1 22.4
0.1 2.24
答:产生的氢气在标准状况下的体积为2.24L.
(2)Zn+H2SO4=ZnSO4+H2↑~△m=2g
1 2
0.1 0.2
m(溶液)=1.12g/cm3×100ml+6.5g-0.2g=118.3g,
答:反应后所得溶液的质量118.3g.
(3)发生反应为:Fe+2HCl═FeCl2+H2↑①、Fe+H2SO4═FeSO4+H2↑②,加入铁粉质量相等,
如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,
若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,
而实际气体体积之比为2:3,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量.通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,对于②反应是Fe不足,
反应①生成气体的物质的量为$\frac{0.1L×2mol/L}{2}$=0.1mol,反应完毕后生成气体的体积之比为2:3,所以由硫酸生成的气体为0.1mol×$\frac{3}{2}$=0.15mol,
设铁的质量为x,则Fe+H2SO4═FeSO4+H2↑②
56g 1mol
x 0.15mol
所以,56g:x=1mol:0.15mol,解得x=8.4g,
答:加入铁的质量为8.4g.
点评 本题考查过量计算、根据方程式计算,题目难度不大,本题注意通过反应方程式判断反应的过量问题是关键.

| A. | 将1 molNH3通入水中得到1L溶液,则NH4+与NH3•H2O粒子总数为NA | |
| B. | 1.2 g NaHSO4晶体中含有离子总数为0.03 NA | |
| C. | 标准状况下,2.24 L SO3含有的分子数为0.1 NA | |
| D. | 14 g乙烯和环丙烷(C3H6)混合气体中的碳原子数为NA |
①将铁块换为等质量的铁粉;
②加入少量NaNO3固体;
③加入少量硫酸氢钠固体;
④延长反应时间;
⑤加热;
⑥将稀硫酸换成98%硫酸,
其中可增大单位时间内氢气收集量的措施有( )
| A. | ①②④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①⑤⑥ |
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| BaCl2溶液体积/mL | 0 | 30 | 60 | 100 | 120 |
| 沉淀质量/g | 0 | 0.699 | x | 2.097 | 2.097 |
| A.混合前,BaCl2溶液的物质的量浓度为0.10mol•L-1 |
| B.混合前,Na2SO4溶液的物质的量浓度为0.15mol•L-1 |
| C.3号实验中沉淀的质量x为1.398g |
| D.完全沉淀60mL Na2SO4溶液消耗BaCl2溶液的体积为80mL |
| A. | A | B. | B | C. | C | D. | D |
 氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )
氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )| A. | 100mol | B. | 250mol | C. | 500mol | D. | 1000 mol |
| A. | 简单离子的半径:W>X>Z | |
| B. | 最简单气态氢化物的稳定性:W>Z>Y | |
| C. | 最高价氧化物对应水化物的酸性:Z>Y>X | |
| D. | W与Y形成的化合物中只含共价键 |
| A. | 若X为IA族时,Y不可能是第三周期VIA族元素 | |
| B. | 由X、Y、Z、W四种元素不可能形成其原子个数比为1:3:1:1的化合物 | |
| C. | Z元素的原子半径一定小于W元素的原子半径 | |
| D. | 若X为IVA族元素时,X、Y两元素可形成含有共价键的离子化合物 |
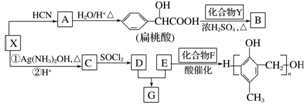
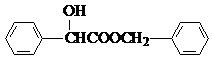 .
.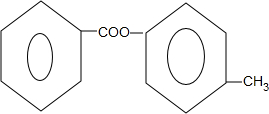 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$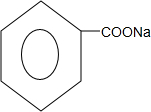 +
+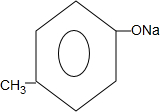 +H2O.
+H2O.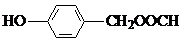 ,
,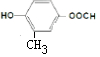 ,
, .
.