题目内容
12. 氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )
氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )| A. | 100mol | B. | 250mol | C. | 500mol | D. | 1000 mol |
分析 氢氧燃料电池的工作原理方程式为:2H2+O2=2H2O,所以消耗的氢气和氧气的质量比是1:8,当耗氢气1kg左右同时消耗氧气约为8kg,故据n=$\frac{m}{M}$计算其物质的量.
解答 解:氢氧燃料电池的工作原理方程式为:2H2+O2=2H2O,所以消耗的氢气和氧气的质量比是1:8,当耗氢气1kg左右同时消耗氧气约为8kg,物质的量是$\frac{8000g}{32g/mol}$=250mol.
故选B.
点评 本题考查学生化学方程式的计算知识,注意知识的应用是关键,难度中等.

练习册系列答案
相关题目
18.资料显示“O2的氧化性随溶液pH的增大逐渐减弱”.某兴趣小组探究不同条件下KI与O2的反应.实验如下.
(1)实验②中生成I2的离子方程式是4I-+O2+4H+=2I2+2H2O.
(2)实验③的目的是验证Cl-是否影响KI与O2的反应.
(3)实验④比②溶液颜色浅的原因是其他条件相同时,CH3COOH是弱电解质,溶液中c(H+)较盐酸小,O2的氧化性减弱.
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
I.对于实验⑥的现象.甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验,验证猜想.
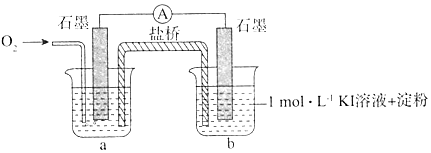
i.烧杯a中的溶液为pH=10的KOH溶液.
ii.实验结果表明,此猜想不成立.支持该结论的实验现象是:通入O2后,电流表指针偏转,烧杯b的溶液颜色变深.
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)3I2+6OH-=IO3-+5I-+3H2O.
(5)该小组同学对实验过程进行了整体反恩.推测实验①的现象产生的原因可能是中性条件下,O2的氧化性比较弱,该反应速率慢,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;实验⑥的现象产生的原因可能是pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.
| 装置 | 烧杯中的液体 | 现象(5分钟后) |
 | ①2mL1mol/LKl溶液+5滴淀粉 | 无明显变化 |
| ②2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L HCl | 溶液变蓝 | |
| ③2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L KCl | 无明显变化 | |
| ④2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(2)实验③的目的是验证Cl-是否影响KI与O2的反应.
(3)实验④比②溶液颜色浅的原因是其他条件相同时,CH3COOH是弱电解质,溶液中c(H+)较盐酸小,O2的氧化性减弱.
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
| 烧杯中的液体 | 现象(5小时后) |
| ⑤2mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
| ⑥2mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |

i.烧杯a中的溶液为pH=10的KOH溶液.
ii.实验结果表明,此猜想不成立.支持该结论的实验现象是:通入O2后,电流表指针偏转,烧杯b的溶液颜色变深.
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)3I2+6OH-=IO3-+5I-+3H2O.
(5)该小组同学对实验过程进行了整体反恩.推测实验①的现象产生的原因可能是中性条件下,O2的氧化性比较弱,该反应速率慢,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;实验⑥的现象产生的原因可能是pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.
19.一杯珍珠奶茶应由三部分组成:糖、奶、茶.奶精(原料是氢化植物油)、奶茶粉放得多,珍珠奶茶的口感就好,成本也高,如果降低成本,可在其中添加白糖或其他香精、奶粉.下列说法正确的是( )
| A. | 奶精能使溴水和酸性KMnO4溶液褪色,其原理相同 | |
| B. | 氢化植物油在稀H2SO4和NaOH溶液中发生水解,所得产物相同 | |
| C. | 白砂糖在人体内水解转化为果糖而被人体吸收 | |
| D. | 奶粉可作为人体所需的一种营养物质 |
1.已知25℃、101kPa 下,石墨、金刚石燃烧的热化学方程式如下:C(石墨)+O2(g)=CO2(g);△H=-393.51kJ•mol-1; C(金刚石)+O2(g)=CO2(g);△H=-395.41kJ•mol-1,下列说法正确的是( )
| A. | 金刚石比石墨稳定 | B. | 石墨转化为金刚石需要吸热 | ||
| C. | 金刚石燃烧产物更稳定 | D. | 等质量时,石墨所含能量高 |
2.下列关于化学与生活的说法不正确的是( )
| A. | 利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验酒后驾车 | |
| B. | 高纯硅可以将太阳能直接转化为电能 | |
| C. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| D. | 工业上Cl2用与石灰乳反应制备漂白粉 |




