题目内容
20. 氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0(1)氮氧化物破坏臭氧层原理为:①NO+O3?NO2+O2 ②NO2+O?NO+O2
常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O?2O2的平衡常数K=K1•K2(用K1、K2表示).氮氧化物在该反应中的作用是催化剂.
(2)SCR法除NO时,投料比一定时有利于提高NO平衡转化率的反应条件是降低温度、减少压强.该法可能发生副反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),减少副反应的主要措施是选择合适的催化剂、控制氧气的用量.
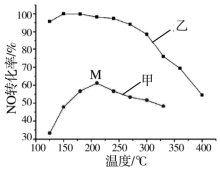
(3)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图.
①工业上选择催化剂乙的原因是低温下有很强的催化活性;
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率一定不是(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率.高于210℃时,NO转化率降低的原因可能是催化剂活性降低,副反应增多.
(4)消除汽车尾气中的NO时,可用尿素[(NH2)2CO]还原NO,既安全又高效,且产物都是空气中含有的成分.与SCR法相比,等物质的量的尿素与氨气可消除的NO物质的量之比为3:1.(不考虑副反应)
分析 (1)①NO+O3?NO2+O2 反应①的平衡常数为K1=$\frac{c(N{O}_{2})c({O}_{2})}{c(NO)c({O}_{3})}$,②NO2+O?NO+O2 反应②的平衡常数为K2=$\frac{c({O}_{2})c(NO)}{c(N{O}_{2})c(O)}$,反应O3+O?2O2的平衡常数K=$\frac{{c}^{2}({O}_{2})}{c({O}_{3})c(O)}$,据此分析计算;
(2)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0,提高NO平衡转化率改变条件使平衡正向进行;
减少副反应应使副反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)平衡逆向进行,结合化学平衡移动原理;
(3)①图象中催化剂在低温下NO转化率大;
②甲催化剂随温度升高NO转化率先增大后减小是因为催化剂在温度高的条件下催化活性减小;高于210℃时,NO转化率降低是催化剂活性降低;
(4)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
尿素[(NH2)2CO]还原NO,既安全又高效,且产物都是空气中含有的成分,反应的化学方程式为2(NH2)2CO+6NO=5N2+2CO2+4H2O.
解答 解:(1)①NO+O3?NO2+O2 反应①的平衡常数为K1=$\frac{c(N{O}_{2})c({O}_{2})}{c(NO)c({O}_{3})}$,②NO2+O?NO+O2 反应②的平衡常数为K2=$\frac{c({O}_{2})c(NO)}{c(N{O}_{2})c(O)}$,反应O3+O?2O2的平衡常数K=$\frac{{c}^{2}({O}_{2})}{c({O}_{3})c(O)}$,据此分析计算得到K=K1•K2,一氧化氮反应生成二氧化氮,二氧化氮反应又生成一氧化氮,说明氮氧化物在该反应中的作用是催化剂的作用,
故答案为:K1•K2;催化剂;
(2)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0,提高NO平衡转化率改变条件使平衡正向进行;
反应为气体体积增大的放热反应,可以降低温度、减小压强使平衡正向进行,减少副反应应使副反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)平衡逆向进行,结合化学平衡移动原理分析,需要选择合适的催化剂、控制氧气用量促进4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0反应进行,避免副反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)进行,
故答案为:降低温度、减小压强;选择合适的催化剂、控制氧气用量;
(3)①图象中曲线变化可知低温下乙的催化作用强,工业上选择催化剂乙的原因是低温下有很强的催化活性,
故答案为:低温下有很强的催化活性;
②甲催化剂随温度升高NO转化率先增大后减小是因为催化剂在温度高的条件下催化活性减小,在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率一定不是该温度下的平衡转化率,高于210℃时,NO转化率降低是催化剂活性降低,副反应增多,
故答案为:一定不是;催化剂活性降低、副反应增多;
(4)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
尿素[(NH2)2CO]还原NO,既安全又高效,且产物都是空气中含有的成分,反应的化学方程式为2(NH2)2CO+6NO=5N2+2CO2+4H2O,等物质的量的尿素与氨气可消除的NO物质的量之比=12:4=3:1,
故答案为:3:1.
点评 本题考查了好像平衡影响因素、平衡常数计算、图象分析判断、催化剂作用的理解应用,掌握基础是解题关键,题目难度中等.

| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3时刻反应已经停止 | |
| B. | A的转化率比B的转化率低 | |
| C. | t1至t2时刻该反应的速率为3mo1•L-1•s-1 | |
| D. | 该反应的化学方程式为2A(g)+B(g)?C(g) |
| A. | 淘汰和禁止黄标车(高污染排放车辆)上路行驶,可减少雾霾天气 | |
| B. | 煤的干馏、液化和气化均为化学变化 | |
| C. | 可利用乙醇、次氯酸钠等消毒剂的氧化杀菌作用防控病毒 | |
| D. | 开发和利用新能源代替化石燃料,符合中国在世界环境日的主题--“践行绿色生活” |
| 选项 | 现象或事实 | 解释 |
| A | 用浸有酸性高锰酸钾溶液的硅藻土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
| A. | A | B. | B | C. | C | D. | D |
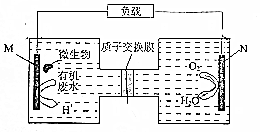 微生物电池是指在微生物的作用下将化学能转化为电能的装置,如图是利用一种微生物将有机废水中的尿素[CO(NH2)3]转化为对环境无害物质的装置.下列叙述错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,如图是利用一种微生物将有机废水中的尿素[CO(NH2)3]转化为对环境无害物质的装置.下列叙述错误的是( )| A. | M电极有CO2和N2生成 | B. | H+透过质子交换膜由左向右移动 | ||
| C. | 微生物促进了反应中电子的转移 | D. | N电极反应式为:O2+2H2O+4e-═4OH- |
| A. | 硬脂酸甘油酯在酸性条件下的水解反应叫皂化反应 | |
| B. | 淀粉和纤维素两者不是互为同分异构体,在一定条件下水解均可得到葡萄糖 | |
| C. | 蛋白质遇甲醛可发生变性而凝聚,遇伤口流血时,可在伤口处滴甲醛水溶液来止血 | |
| D. | 在乙酸与乙醛的混合溶液中加入银氨溶液,水浴加热,可观察到银镜现象 |
| A. | 加入Al能放出H2的溶液:K+、Cu2+、NO3-、SO42- | |
| B. | 某无色透明溶液:Fe2+、ClO-、SiO32-、Na + | |
| C. | 加入(NH4)2CO3后加热,有气体产生的溶液:Na+、K+、NO3-、Cl- | |
| D. | 0.1mol/LNaHCO3溶液:Na+、A13+、SO42-、NO3- |
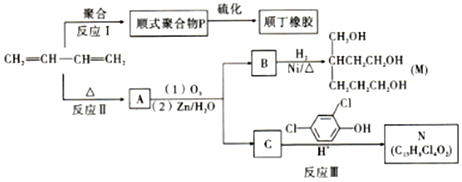
 +
+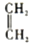 $\stackrel{△}{→}$
$\stackrel{△}{→}$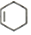
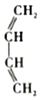
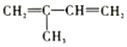 的名称是2-甲基-1,3-丁二烯.
的名称是2-甲基-1,3-丁二烯. b.
b. c.
c.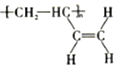
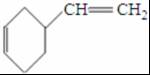 ;反应III的化学方程式是
;反应III的化学方程式是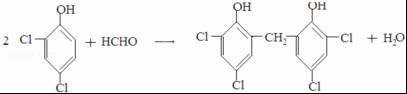 ;1molB完全转化成M所消耗H2的质量是6g.
;1molB完全转化成M所消耗H2的质量是6g.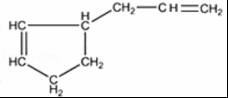 .
.