题目内容
18.下列说法正确的是( )| A. | 氧化还原反应的本质是化合价生了变化 | |
| B. | 化合价升高的物质被氧化 | |
| C. | 得到电子的物质被氧化 | |
| D. | 氧化还原反应中,先有氧化后有还原 |
分析 有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂被氧化,以此解答该题.
解答 解:A.氧化还原反应的本质为电子的转移,其特征为化合价的变化,故A错误;
B.元素化合价升高,失电子,被氧化,故B正确;
C.得电子被还原,故C错误;
D.氧化还原反应中,氧化反应与还原反应同时发生,故D错误.
故选B.
点评 本题考查氧化还原反应,明确氧化还原反应的实质、特征等,并熟悉氧化还原反应中的基本概念来解答,难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
8.离子方程式:Ca2++HCO3-+OH-→CaCO3↓+H2O不能表示的反应有( )
| A. | 澄清石灰水与碳酸氢钠溶液 | B. | 澄清石灰水与碳酸氢铵溶液 | ||
| C. | 氢氧化钠溶液与碳酸氢钙溶液 | D. | 澄清石灰水与碳酸氢钙溶液 |
6.将NO2、NH3、O2混合气22.4L通过稀硫酸后,溶液质量增加了26.7g,气体体积缩小为4.48L.(气体体积均在标况下测定)剩余气体能使带火星的木条着火,则混合气体的平均相对分子质量为(4NO2+O2+2H2O=4HNO3)( )
| A. | 28.1 | B. | 30.2 | C. | 33.1 | D. | 34.0 |
13.3A(g)+3B(g)?2C(g)△H<0,达到平衡时,改变以下条件,一定会使平衡向正向移动的是( )
| A. | 增大C的浓度 | B. | 增大压强 | C. | 升高温度 | D. | 加催化剂 |
10.在25mL浓度为0.1mol/L的某酸HA中加入20mL等浓度NaOH溶液恢复到室温,溶液pH=7,下列叙述正确的是( )
| A. | HA溶液中由水电离出来的c(H+)=10-13mol/L | |
| B. | 加入NaOH溶液过程中,$\frac{c({H}^{+})}{c(HA)}$比值减小 | |
| C. | 混合液中:c(Na+)=c(A-)+c(HA) | |
| D. | 混合液中HA电离常数Ka增大 |
12.( I )向一体积不变的密闭容器中充入2mol A,0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)═3C(g),各物质的浓度随时间变化的关系如图 1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况且t2,t3,t4各改变一种不同的条件.

(1)若t1=15min,则t0~t1阶段以C的浓度变化表示的反应速率v(C)=0.02mol/(L•min).
(2)t3时改变的条件为减小压强或取出部分平衡混合气体,B的起始物质的量为1mol,
(3)t4~t5阶段,若A的物质的量减少了0.01mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式:2A(g)+B(g)?3C(g)△H=+200aKJ/mol.
(II)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡不移动(填:向左,向右,不)
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+bmol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式:$\frac{[C]{\;}^{p}}{[A]^{m}}$.

(1)若t1=15min,则t0~t1阶段以C的浓度变化表示的反应速率v(C)=0.02mol/(L•min).
(2)t3时改变的条件为减小压强或取出部分平衡混合气体,B的起始物质的量为1mol,
(3)t4~t5阶段,若A的物质的量减少了0.01mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式:2A(g)+B(g)?3C(g)△H=+200aKJ/mol.
(II)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+bmol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式:$\frac{[C]{\;}^{p}}{[A]^{m}}$.
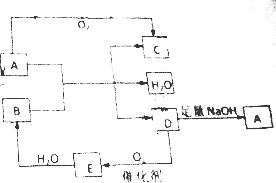 A、B、C、D、E五种物质都含有同一种元素,其中D在常温下为无色有刺激性气味的有毒气体,在一定条件下有如图所示的转化关系.
A、B、C、D、E五种物质都含有同一种元素,其中D在常温下为无色有刺激性气味的有毒气体,在一定条件下有如图所示的转化关系. ;
;