题目内容
3.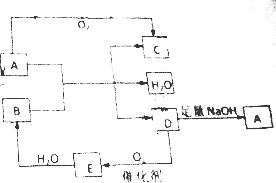 A、B、C、D、E五种物质都含有同一种元素,其中D在常温下为无色有刺激性气味的有毒气体,在一定条件下有如图所示的转化关系.
A、B、C、D、E五种物质都含有同一种元素,其中D在常温下为无色有刺激性气味的有毒气体,在一定条件下有如图所示的转化关系.填写下空白:
(1)A、B、C、D、E五种物质中共同元素原子的元素符号为S;其原子结构示意图为
 ;
;(2)A、B反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(3)工业上制取气体D的化学方程式为:4FeS2+1102$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
分析 D在常温下为无色有刺激性气味的有毒气体,由转化关系可知,D发生催化氧化反应生成E,且E与水反应,则D为SO2,E为SO3,B为H2SO4,D与NaOH反应生成的A为Na2SO3,C为Na2SO4,以此来解答.
解答 解:D在常温下为无色有刺激性气味的有毒气体,由转化关系可知,D发生催化氧化反应生成E,且E与水反应,则D为SO2,E为SO3,B为H2SO4,D与NaOH反应生成的A为Na2SO3,C为Na2SO4,
(1)A、B、C、D、E五种物质中共同元素原子的元素符号为S,其原子结构示意图为 ,故答案为:S;
,故答案为:S; ;
;
(2)A、B反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(3)工业上制取气体SO2的化学方程式为4FeS2+1102$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,故答案为:4FeS2+1102$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
点评 本题考查无机物的推断,为高频考点,把握D的催化氧化剂E与水的反应为解答的关键,侧重分析与推断能力的考查,注意S及其化合物的相互转化,题目难度不大.

练习册系列答案
相关题目
13.下列关于容量瓶及其使用方法的叙述中,正确的是( )
①容量瓶是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶贮存配制好的溶液
⑤可以用500mL 容量瓶配制250mL 溶液.
①容量瓶是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶贮存配制好的溶液
⑤可以用500mL 容量瓶配制250mL 溶液.
| A. | ①② | B. | ②④ | C. | ①②④⑤ | D. | ①②④ |
14.化学与生活、社会密切相关.下列说法错误的是( )
| A. | 二氧化氮能使织物褪色,对金属材料也有腐蚀作用 | |
| B. | 亚硝酸盐属于食物防腐剂,可以适量地添加于食物中 | |
| C. | 漂白粉在空气中能稳定存在,可用于漂白纸张 | |
| D. | 大量燃烧化石燃料是造成雾霾天气的重要原因 |
11.下列有关有机化合物结构和性质的叙述,正确的是( )
| A. | 乙酸的酯化、丙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 | |
| B. | C8H10含苯环的烃的同分异构体有3种 | |
| C. | 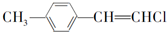 分子中的所有原子不可能共平面 分子中的所有原子不可能共平面 | |
| D. | 莽草酸(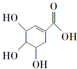 )能与溴水发生取代反应而褪色 )能与溴水发生取代反应而褪色 |
18.下列说法正确的是( )
| A. | 氧化还原反应的本质是化合价生了变化 | |
| B. | 化合价升高的物质被氧化 | |
| C. | 得到电子的物质被氧化 | |
| D. | 氧化还原反应中,先有氧化后有还原 |
8.化学与生产和生活密切相关,下列说法正确的是( )
| A. | 用漂白粉可以净化饮用水 | |
| B. | 铜的金属性比铁弱,所以可用铜罐代替铁罐贮藏浓硝酸 | |
| C. | 合成纤维和光导纤维都是人工合成的有机高分子化合物 | |
| D. | 工业上可用石灰乳对煤燃烧形成的烟气进行脱硫,最终能制得石膏 |
15.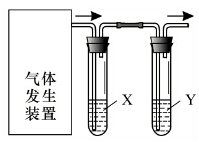 实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
 实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( ) | 选项 | 实验目的 | 试剂X | 试剂Y |
| A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
| B | 检验FeSO4受热分解产生的气体中由SO3和SO2 | BaCl2溶液 | 品红溶液 |
| C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
| D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |
| A. | A | B. | B | C. | C | D. | D |
18.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答下列问题:
(1)不考虑其他组的结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸若pH=7,HA是强酸,若pH>7,则HA是弱酸.
(2)不考虑其他组的结果,单从乙组情况分析,c1是否一定等于0.2mol•L-1否?(填“是”或“否”).
混合溶液中c(A-)与c(Na+)离子浓度的大小关系是C(填序号).
A.前者大 B.后者大 C.一样大 D.无法判断
(3)从丙组结果分析,HA是弱酸(填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-4mol•L-1.
| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | C1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)不考虑其他组的结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸若pH=7,HA是强酸,若pH>7,则HA是弱酸.
(2)不考虑其他组的结果,单从乙组情况分析,c1是否一定等于0.2mol•L-1否?(填“是”或“否”).
混合溶液中c(A-)与c(Na+)离子浓度的大小关系是C(填序号).
A.前者大 B.后者大 C.一样大 D.无法判断
(3)从丙组结果分析,HA是弱酸(填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-4mol•L-1.
