题目内容
10.在25mL浓度为0.1mol/L的某酸HA中加入20mL等浓度NaOH溶液恢复到室温,溶液pH=7,下列叙述正确的是( )| A. | HA溶液中由水电离出来的c(H+)=10-13mol/L | |
| B. | 加入NaOH溶液过程中,$\frac{c({H}^{+})}{c(HA)}$比值减小 | |
| C. | 混合液中:c(Na+)=c(A-)+c(HA) | |
| D. | 混合液中HA电离常数Ka增大 |
分析 在25mL浓度为0.1mol/L的某酸HA中加入20mL等浓度NaOH溶液恢复到室温,溶液pH=7,溶液呈中性,c(H+)=c(OH-)=10-7mol/L,溶液中发生反应HA+NaOH=NaA+H2O,溶液中溶质为HA和NaA的混合溶液,证明HA为弱酸,
A.HA为弱酸,c(H+)<0.1mol/L,依据溶液中离子积常数计算水电离出的氢氧根离子浓度分析;
B.加入氢氧化钠溶液发生反应:HA+NaOH=NaA+H2O,c(H+)减小,c(HA)浓度减小,依据电离平衡常数不变分析;
C.分析可知溶液中溶质为HA和NaA的混合溶液,依据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)分析;
D.平衡常数随温度变化,不随浓度变化;
解答 解:A.HA为弱酸,c(H+)<0.1mol/L,依据溶液中离子积常数计算水电离出的氢氧根离子浓度分析,HA溶液中由水电离出来的c(H+)=c(OH-)>10-13mol/L,故A错误;
B.加入氢氧化钠溶液发生反应:HA+NaOH=NaA+H2O,c(H+)减小,c(HA)浓度减小,依据电离平衡常数不变分析,K=$\frac{[{H}^{+}][{A}^{-}]}{[HA]}$,随反应进行[A-]增大,$\frac{[{H}^{+}]}{[HA]}$减小,故B正确;
C.分析可知溶液中溶质为HA和NaA的混合溶液,依据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),溶液pH=7,溶液呈中性,c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(A-),则c(Na+)=c(A-)+c(HA)错误,故C错误;
D.平衡常数随温度变化,不随浓度变化,混合液中HA电离常数Ka不变,故D错误;
故选B.
点评 本题考查了酸碱反应的定量关系,溶液酸碱性的判断,主要是电离平衡常数、离子积常数、溶液电荷守恒的应用,题目难度中等.

| A. | 明矾与水反应成的Al(OH)3胶体能吸附水中悬浮物,可用于净水 | |
| B. | 江河入海口三角洲的形成通常与胶体的性质有关系 | |
| C. | 水泥厂、冶金厂用高压电作用于气溶胶以除去烟尘,是利用了电泳原理 | |
| D. | 溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸 |
| A. | 铁和稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙溶于稀盐酸中 CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液与盐酸反应 HCO3-+H+═CO2↑+H2O | |
| D. | 氧化铜与盐酸反应 O2-+2H+═H2O |
| A. | 氧化还原反应的本质是化合价生了变化 | |
| B. | 化合价升高的物质被氧化 | |
| C. | 得到电子的物质被氧化 | |
| D. | 氧化还原反应中,先有氧化后有还原 |
| A. | 氟化氢在所有卤化氢中热稳定性最强 | |
| B. | 浓H2SO4加入氟化钙固体中,加热,有氟化氢气体产生 | |
| C. | 100ml 0.1 mol•Lˉ1氢氟酸中,c(H+)小于0.1 mol•Lˉ1 | |
| D. | 测得常温下0.1mol•L-1NaF溶液的pH>7 |
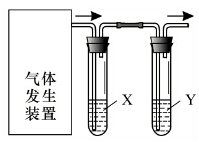 实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( ) | 选项 | 实验目的 | 试剂X | 试剂Y |
| A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
| B | 检验FeSO4受热分解产生的气体中由SO3和SO2 | BaCl2溶液 | 品红溶液 |
| C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
| D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)=10-7 mol•L-1,Kw不变 |
| A. | 1 L CO的质量小于1 L O2的质量 | |
| B. | 常温下9 g H2O中所含原子数为1.5NA | |
| C. | 含1 mol FeCl3的溶液水解后生成的氢氧化铁胶体粒子的数目为NA | |
| D. | OH-的摩尔质量为17 g |
