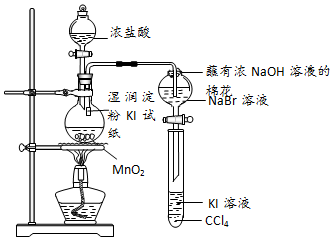
题目内容
3.在0.1mol•L-1CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量CH3COONa固体,平衡向逆反应方向移动,c(CH3COO-)增大 | |
| C. | 加入少量0.1 mol•L-1HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 | |
| D. | 加入少量NaOH固体,平衡向正反应方向移动,酸性增强 |
分析 因加入水、加热促进弱电解质的电离,加酸抑制弱酸的电离,加入与弱电解质电离出相同离子的电解质抑制电离,以此来解答.
解答 解:A.加水促进弱电解质的电离,则电离平衡正向移动,故A错误;
B.加入少量CH3COONa固体,由电离平衡可知,c(CH3COO-)增大,则电离平衡逆向移动,故B正确;
C.加入少量0.1 mol•L-1HCl溶液,氢离子浓度为0.1mol•L-1,加入少量0.1mol•L-1HCl溶液,c(H+)不变,故C错误;
D.加入少量NaOH固体,与CH3COOH电离生成的H+结合,使电离平衡正向移动,酸性减弱,故D错误;
故选B.
点评 本题考查电离平衡的移动,明确影响平衡移动的因素即可解答,注意利用加水促进电离及同离子效应来分析解答.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
13.常温常压下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(Fe3+)=0.1 mol/L溶液中:Na+、NH4+、SCN-、SO42- | |
| B. | 能溶解CaCO3的溶液中:Fe3+、Ca2+、Cl-、NO3- | |
| C. | 由水电离出的c(H+)=1×10-2mol/L的溶液中:Na+、Ba2+、HCO3-、Cl- | |
| D. | 强碱性溶液中:K+、Na+、ClO-、I- |
14.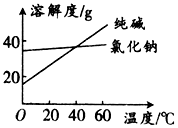 阅读分析下列材料:
阅读分析下列材料:
材料1:纯碱和氯化钠溶解度随温度变化的曲线图:
材料2:两种有机物的物理性质:
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,合适的方法是C(填字母,下同);将乙二醇和丙三醇混合液相互分离的最佳方法是:蒸馏.
A、萃取 B、蒸馏 C、溶解、蒸发浓缩、冷却结晶、过滤 D、分液
(2)某纯碱样品中可能含有氯化钠,设计一个简易实验加以证明:取样品少许于试管中,加入蒸馏水溶解,加入硝酸酸化的硝酸银溶液.出现白色沉淀,证明含有氯化钠 (写出简要操作方法、现象和结论)
(3)某同学设计两套方案测定纯碱样品(含少量的氯化钠)中碳酸钠的质量分数.
方案1:取mg纯碱样品,加入过量的盐酸,充分反应后,蒸发、灼烧、称重得bg固体,计算出纯碱样品纯度.
方案2:取mg纯碱样品,溶于水加入过量的氯化钙溶液,过滤、洗涤、烘干、称重得ag固体,计算出纯碱样品纯度.
①写出方案1涉及的反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
②利用方案2中的数据计算该纯碱的纯度:$\frac{53a}{50m}$×100%.
 阅读分析下列材料:
阅读分析下列材料:材料1:纯碱和氯化钠溶解度随温度变化的曲线图:
材料2:两种有机物的物理性质:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇 C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇及其他有机溶剂 |
| 丙三醇 C3H8O3 | 17.9 | 290 | 1.26 | 能跟水和酒精以任意比互溶;易溶于其他有机溶剂 |
A、萃取 B、蒸馏 C、溶解、蒸发浓缩、冷却结晶、过滤 D、分液
(2)某纯碱样品中可能含有氯化钠,设计一个简易实验加以证明:取样品少许于试管中,加入蒸馏水溶解,加入硝酸酸化的硝酸银溶液.出现白色沉淀,证明含有氯化钠 (写出简要操作方法、现象和结论)
(3)某同学设计两套方案测定纯碱样品(含少量的氯化钠)中碳酸钠的质量分数.
方案1:取mg纯碱样品,加入过量的盐酸,充分反应后,蒸发、灼烧、称重得bg固体,计算出纯碱样品纯度.
方案2:取mg纯碱样品,溶于水加入过量的氯化钙溶液,过滤、洗涤、烘干、称重得ag固体,计算出纯碱样品纯度.
①写出方案1涉及的反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
②利用方案2中的数据计算该纯碱的纯度:$\frac{53a}{50m}$×100%.
15. 在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
a.此平衡体系,升温平衡向右移动.( A.向左、B.向右、C.不)
b.对原平衡,在t0时升高温度对化学反应速率产生影响,在图中绘出速率变化图.
 在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
b.对原平衡,在t0时升高温度对化学反应速率产生影响,在图中绘出速率变化图.
5.利用所学化学知识回答问题
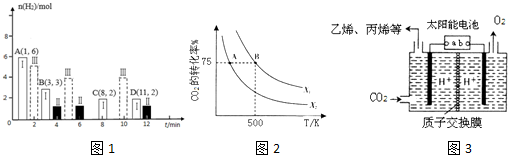
Ⅰ、甲醇是重要的化工原料,又可称为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H=?
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-58kJ/mol
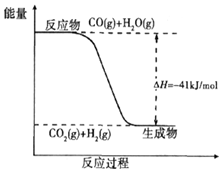
③CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
则x=413kJ/mol.
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图1中状态Ⅰ(图1中实线)所示.图1中数据A(1,6)代表在1min时H2的物质的量是6mol.
①T℃时,状态Ⅰ条件下,平衡常数K=0.5;
②其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度>(填“>”“<”或“=”)T℃;
③一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是bc.
a. 2个C=O断裂的同时有2个H-O生成 b.容器中混合气体平均摩尔质量不变
c.v逆(H2)=3v正(CH3OH) d.甲醇和水蒸气的体积比保持不变
Ⅱ、二氧化碳的回收利用是环保领域研究的热点课题.
(1)CO2经过催化氢化合成低碳烯烃.在2L恒容密闭容器中充入2moI CO2和nmol H2,在一定条件下发生反应:2C02(g)+6H2(g)?CH2=CH2(g)+4H20(g),△H=-128kJ/mol.CO2的转化率与温度、投料比[X=$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图2所示.
①X2> X1(填“>”、“<”或“=”)
②在500K时,若B点的投料比为3.5,且从反应开始到B点需要10min,则v(H2)=0.225mol/(L.min).
(2)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图3如下,则左侧产生乙烯的电极反应式为2CO2+12e-+12H+=CH2=CH2+4H2O.

Ⅰ、甲醇是重要的化工原料,又可称为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H=?
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-58kJ/mol
③CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C $\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | x |
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图1中状态Ⅰ(图1中实线)所示.图1中数据A(1,6)代表在1min时H2的物质的量是6mol.
①T℃时,状态Ⅰ条件下,平衡常数K=0.5;
②其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度>(填“>”“<”或“=”)T℃;
③一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是bc.
a. 2个C=O断裂的同时有2个H-O生成 b.容器中混合气体平均摩尔质量不变
c.v逆(H2)=3v正(CH3OH) d.甲醇和水蒸气的体积比保持不变
Ⅱ、二氧化碳的回收利用是环保领域研究的热点课题.
(1)CO2经过催化氢化合成低碳烯烃.在2L恒容密闭容器中充入2moI CO2和nmol H2,在一定条件下发生反应:2C02(g)+6H2(g)?CH2=CH2(g)+4H20(g),△H=-128kJ/mol.CO2的转化率与温度、投料比[X=$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图2所示.
①X2> X1(填“>”、“<”或“=”)
②在500K时,若B点的投料比为3.5,且从反应开始到B点需要10min,则v(H2)=0.225mol/(L.min).
(2)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图3如下,则左侧产生乙烯的电极反应式为2CO2+12e-+12H+=CH2=CH2+4H2O.
6.碳、氮及其化合物在生产中有重要应用.
(1)设反应 ①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如表:
现有反应 ③H2(g)+CO2(g)?CO(g)+H2O(g)△H=Q3
结合表数据,根据反应①、②推导出推导出Q1、Q2、Q3的关系式Q3=Q1-Q2,反应③是吸热(填“放”或“吸”)热反应.
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,其中两个反应为:
Ⅰ.CH4(g)+4NO(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+CO2(g)+2H2O(g)
Ⅱ.CH4(g)+2NO2(g) $\frac{\underline{\;催化剂\;}}{\;}$N2(g)+CO2(g)+2H2O(g)
实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应Ⅱ,测得在不同温度、不同投料比时,NO2的平衡转化率如表:
①写出该反应平衡常数的表达式K=$\frac{c({N}_{2})•c(C{O}_{2})•{c}^{2}({H}_{2}O)}{c(C{H}_{4})•{c}^{2}(N{O}_{2})}$,若降低温度,提高[n(NO2)/n(CH4)]
投料比,则K将增大.(填“增大”、“减小”或“不变”)
②400K时,将投料比为1的NO2和CH4的混合气体共0.04mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数17.4%.
③收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V(NO):V(NO2)=1:1.
④在密闭容器内先通入一定量的CH4,然后再充入一定量的NO2.在不同温度下,同时发生反应Ⅱ:并在 t秒时测定其中NO2转化率,绘得图象如图所示:
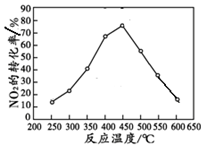
产生这一现象的原因是在250℃-450℃时,NOx转化率随温度升高而增大:反应未建立平衡,温度升高反应正向进行.450℃-600℃(温度较高)时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高反而减小.
(1)设反应 ①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如表:
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
结合表数据,根据反应①、②推导出推导出Q1、Q2、Q3的关系式Q3=Q1-Q2,反应③是吸热(填“放”或“吸”)热反应.
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,其中两个反应为:
Ⅰ.CH4(g)+4NO(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+CO2(g)+2H2O(g)
Ⅱ.CH4(g)+2NO2(g) $\frac{\underline{\;催化剂\;}}{\;}$N2(g)+CO2(g)+2H2O(g)
实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应Ⅱ,测得在不同温度、不同投料比时,NO2的平衡转化率如表:
| 投料比[n(NO2)/n(CH4)] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
投料比,则K将增大.(填“增大”、“减小”或“不变”)
②400K时,将投料比为1的NO2和CH4的混合气体共0.04mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数17.4%.
③收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V(NO):V(NO2)=1:1.
④在密闭容器内先通入一定量的CH4,然后再充入一定量的NO2.在不同温度下,同时发生反应Ⅱ:并在 t秒时测定其中NO2转化率,绘得图象如图所示:

产生这一现象的原因是在250℃-450℃时,NOx转化率随温度升高而增大:反应未建立平衡,温度升高反应正向进行.450℃-600℃(温度较高)时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高反而减小.
 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.