��Ŀ����
5��������ѧ��ѧ֪ʶ�ش�����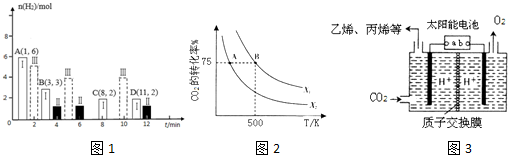
�״�����Ҫ�Ļ���ԭ�ϣ��ֿɳ�Ϊȼ�ϣ���ҵ�����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�������������Ӧ���£�
��CO��g��+2H2��g���TCH3OH��g����H=��
��CO2��g��+3H2��g���TCH3OH��g��+H2O��g����H=-58kJ/mol
��CO2��g��+H2��g���TCO��g��+H2O��g����H=+41kJ/mol
�ش��������⣺
��1����֪��Ӧ���е���صĻ�ѧ�������������£�
| ��ѧ�� | H-H | C-O | C $\frac{\underline{\;��\;}}{\;}$O | H-O | C-H |
| E/��kJ•mol-1�� | 436 | 343 | 1076 | 465 | x |
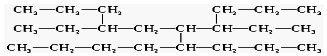
��2����T��ʱ��6molCO2��8molH2����2L�ܱ������з�����Ӧ�ڣ����H2�����ʵ�����ʱ��仯��ͼ1��״̬��ͼ1��ʵ�ߣ���ʾ��ͼ1������A��1��6��������1minʱH2�����ʵ�����6mol��
��T��ʱ��״̬�������£�ƽ�ⳣ��K=0.5��
�������������䣬���ı��¶�ʱ�����H2�����ʵ�����ʱ��仯��ͼ��״̬����ʾ����״̬���Ӧ���¶ȣ����������������=����T�棻
��һ���¶��£��˷�Ӧ�ں��������н��У����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���ݵ���bc��
a�� 2��C=O���ѵ�ͬʱ��2��H-O���� b�������л������ƽ��Ħ����������
c��v�棨H2��=3v����CH3OH�� d���״���ˮ����������ȱ��ֲ���
������̼�Ļ��������ǻ��������о����ȵ���⣮
��1��CO2�������⻯�ϳɵ�̼ϩ������2L�����ܱ������г���2moI CO2��nmol H2����һ�������·�����Ӧ��2C02��g��+6H2��g��?CH2=CH2��g��+4H20��g������H=-128kJ/mol��CO2��ת�������¶ȡ�Ͷ�ϱ�[X=$\frac{n��{H}_{2}��}{n��C{O}_{2}��}$]�Ĺ�ϵ��ͼ2��ʾ��
��X2�� X1�����������������=����
����500Kʱ����B���Ͷ�ϱ�Ϊ3.5���Ҵӷ�Ӧ��ʼ��B����Ҫ10min����v��H2��=0.225mol/��L��min����
��2����ϡ����Ϊ�������Һ������̫���ܽ�CO2ת��Ϊ��̼ϩ��������ԭ��ͼ3���£�����������ϩ�ĵ缫��ӦʽΪ2CO2+12e-+12H+=CH2=CH2+4H2O��
���� ��1�����ݸ�˹���ɺͻ�ѧ��Ӧ�ʱ�=��Ӧ������ܺ�-����������ܺͼ��㣻
��2������ͼ��֪��T��ʱƽ��ʱ���������ʵ���Ϊ2mol���μӷ�Ӧ�����������ʵ���Ϊ8mol-2mol=6mol��������Ũ�ȱ仯��Ϊ$\frac{6mol}{2L}$=3mol/L���ݴ˽������ʽ����ƽ��ʱ����ֵ�ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻
����ͼ��֪�����ߢ�ƽ���ʱ�����̣���Ӧ���ʼӿ죬ƽ��ʱ���������ʵ�������ƽ�����淴Ӧ�ƶ����ݴ��жϣ�
�۴ﵽ��Ӧƽ��״̬ʱ����һ�������µĿ��淴Ӧ�����Ӧ���ʺ��淴Ӧ������ȣ���Ӧ������и���ɳɷֵİٷֺ������ֲ��䣬�÷�Ӧ�ʹﵽƽ��״̬���ݴ˷������
��1������ͬ�����£�Ͷ�ϱ�[X=$\frac{n��{H}_{2}��}{n��C{O}_{2}��}$]Խ������̼��ת����Խ�ݴ��ж�X1��X2����Դ�С��
����B���Ͷ�ϱ�Ϊ3.5���Ҵӷ�Ӧ��ʼ��B����Ҫ10min��n��CO2��=2mol����n��H2��=10mol��B�������̼��ת����Ϊ75%����μӷ�Ӧ��n��CO2��=2mol��75%=1.5mol�����ݶ�����̼������֮��Ĺ�ϵʽ֪���μӷ�Ӧ��n��H2��=3n��CO2��=4.5mol����v��H2��=$\frac{\frac{��n}{V}}{��t}$��
��2�������϶�����̼�õ��Ӻ������ӷ�Ӧ������ϩ��ˮ��
��� �⣺��1�����ݸ�˹���ɼ����CO��g��+2H2��g���TCH3OH��g����H=��-��=-58kJ/mol-41kJ/mol=-99kJ/mol
�ʱ�=��Ӧ������ܺ�-����������ܺͣ���Ӧ�ٵġ�H=-99kJ/mol=1076kJ/mol+2��436kJ/mol-3��xkJ/mol-343kJ/mol-465kJ/mol��
��ã�x=413kJ/mol��
�ʴ�Ϊ��413kJ/mol��
��2������ͼ��֪��T��ʱƽ��ʱ���������ʵ���Ϊ2mol���μӷ�Ӧ�����������ʵ���Ϊ8mol-2mol=6mol��������Ũ�ȱ仯��Ϊ$\frac{6mol}{2L}$=3mol/L����
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ��mol/L����3 4 0 0
�仯��mol/L����1 3 1 1
ƽ�⣨mol/L����2 1 1 1
�ʸ��¶���ƽ�ⳣ��k=$\frac{c��C{H}_{3}OH��•c��{H}_{2}O��}{c��C{O}_{2}��•{c}^{3}��{H}_{2}��}$=$\frac{1��1}{2��{1}^{3}}$=0.5��
�ʴ�Ϊ��0.5
����ͼ��֪�����ߢ�ƽ���ʱ�����̣���Ӧ���ʼӿ죬ƽ��ʱ���������ʵ�������ƽ�����淴Ӧ�ƶ����������ı������£�
�ʴ�Ϊ������
��a.2��C=O���ѵ�ͬʱ��2��H-O���ɣ�����ָ����Ӧ�������Բ����жϴﵽ��ƽ��״̬����a����
b�������л������ƽ��Ħ���������䣬�����淴Ӧ������ȣ�������Ӧ�ﵽƽ��״̬����b��ȷ��
c��v�棨H2��=3v����CH3OH���������淴Ӧ������ȣ�������Ӧ�ﵽƽ��״̬����c��ȷ��
d���״���ˮ������������������ʼ�ձ��ֲ��䣬���Բ����жϴﵽ��ƽ��״̬����d����
�ʴ�Ϊ��b c��
��1������ͬ�����£�Ͷ�ϱ�[X=$\frac{n��{H}_{2}��}{n��C{O}_{2}��}$]Խ������̼��ת����Խ����ͼ֪����ͬ�¶���X1��ת���ʴ���X2������X1��X2��
�ʴ�Ϊ������
����B���Ͷ�ϱ�Ϊ3.5���Ҵӷ�Ӧ��ʼ��B����Ҫ10min��n��CO2��=2mol����n��H2��=7mol��B�������̼��ת����Ϊ75%����μӷ�Ӧ��n��CO2��=2mol��75%=1.5mol�����ݶ�����̼������֮��Ĺ�ϵʽ֪���μӷ�Ӧ��n��H2��=3n��CO2��=4.5mol����v��H2��=$\frac{\frac{��n}{V}}{��t}$=$\frac{\frac{4.5mol}{2L}}{10min}$=0.225mol/��L��min����
�ʴ�Ϊ��0.225mol/��L��min����
��2�������϶�����̼�õ��Ӻ������ӷ�Ӧ������ϩ��ˮ���缫��ӦʽΪ��2CO2+12e-+12H+=CH2=CH2+4H2O��
�ʴ�Ϊ��2CO2+12e-+12H+=CH2=CH2+4H2O��
���� ���⿼�����ʵ���Ũ����ʱ��仯���ߡ���ѧƽ�ⳣ������ѧ��Ӧ���ʵ��йؼ��㡢Ӱ�컯ѧƽ������صȣ��Ѷ��еȣ�ע��������ߵı仯�ص㣮

| A�� | �ںϳɰ���ҵ�У���ѹ���������NH3�IJ��� | |
| B�� | ֱ��ȼ��ú���罫ú������ӹ�����ȼ�յ�Ч�ʺ� | |
| C�� | ��ʯȼ�ϰ���ʯ�͡���Ȼ����ú������ | |
| D�� | ��ʱ������������£��ӽ����Ϸ��������У�������������� |
| A�� | ����ˮʱ��ƽ�����淴Ӧ�����ƶ� | |
| B�� | ��������CH3COONa���壬ƽ�����淴Ӧ�����ƶ���c��CH3COO-������ | |
| C�� | ��������0.1 mol•L-1HCl��Һ��ƽ�����淴Ӧ�����ƶ�����Һ��c��H+����С | |
| D�� | ��������NaOH���壬ƽ��������Ӧ�����ƶ���������ǿ |
| A�� | ��Һ��Ca2+��Ŀ���� | B�� | ��Һ��c��Ca2+������ | ||
| C�� | ��ҺpHֵ���� | D�� | ��ҺpHֵ���� |
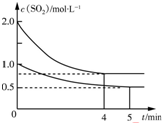 ��ס��������ݻ���Ϊ1L�ĺ��º��ݵ��ܱ������У��ֱ����һ������SO2��O2�����У��׳���2mol SO2��1mol O2���ҳ���1mol SO2��0.5mol O2����������Ӧ��2SO2��g��+O2��g��?2SO3��g����H=-197.74kJ•mol-1��һ��ʱ���ﵽƽ�⣬�����������c��SO2����mol•L-1����ʱ��t��min���ı仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ�������
��ס��������ݻ���Ϊ1L�ĺ��º��ݵ��ܱ������У��ֱ����һ������SO2��O2�����У��׳���2mol SO2��1mol O2���ҳ���1mol SO2��0.5mol O2����������Ӧ��2SO2��g��+O2��g��?2SO3��g����H=-197.74kJ•mol-1��һ��ʱ���ﵽƽ�⣬�����������c��SO2����mol•L-1����ʱ��t��min���ı仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | �ų�������Q��Q���ף���2Q���ң� | |
| B�� | ��ϵ��ѹǿp��p���ף���2p���ң� | |
| C�� | ����ǰ5 min�ڵķ�Ӧ����v��O2��=0.05mol•L-1•min-1 | |
| D�� | ���������������䣬����ʼʱ�����г���0.4 mol SO2��0.2 mol O2��0.4 mol SO3�����ʱv��������v���棩 |
| A�� | ��������Һ�м����������ռ���Һ��Al3++3OH-=Al��OH��3�� | |
| B�� | �ں��е����ʵ�����Fe��NO3��2��KI��ɵĻ����Һ�е���ϡ���3Fe2++4H++NO3-=3Fe3++NO��+2H2O | |
| C�� | ̼�������Һ�еμ�������NaOH��Һ��HCO3-+OH-=CO32-+H2O | |
| D�� | ������Һ�ʼ��Ե�ԭ��S2-+2H2O?H2S+2OH- |
 �Ըߴ�H2Ϊȼ�ϵ����ӽ���Ĥȼ�ϵ�ؾ�������Ч�ʸߡ�����Ⱦ���ŵ㣬��ȼ����������CO���������̵���������Լ״�Ϊԭ����ȡ�ߴ�H2����Ҫ�о�����
�Ըߴ�H2Ϊȼ�ϵ����ӽ���Ĥȼ�ϵ�ؾ�������Ч�ʸߡ�����Ⱦ���ŵ㣬��ȼ����������CO���������̵���������Լ״�Ϊԭ����ȡ�ߴ�H2����Ҫ�о�����