题目内容
10.下列说法正确的是( )| A. | 16gO2与16gO3体积比为3:2 | |
| B. | 由H2、O2组成的混合气,密度是氢气的8.5倍,混合气中H2的质量分数为50% | |
| C. | 将标况下22.4L的HCl气体溶于1 L水中配制1mol/L的HCl溶液 | |
| D. | 1mL 3mol/L的K2SO4溶液和100mL 1mol/L的Al2(SO4)3溶液,SO42-浓度相同 |
分析 A.由n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算;
B.混和气体的密度为相同条件下H2密度的8.5倍,则混合气体的平均相对分子质量为8.5×2=17,可计算出两种气体的物质的量之比,进而计算质量关系;
C.溶液的体积不等于水的体积;
D.根据化学式中含有离子数目计算离子的浓度,与溶液的体积无关.
解答 解:A.16gO2的物质的量为0.5mol,16gO3的物质的量为$\frac{2}{3}$mol,体积与温度、压强有关,所以无法计算体积的关系,故A错误;
B.混和气体的密度为相同条件下H2密度的8.5倍,则混合气体的平均相对分子质量为8.5×2=17,
设混合气体中含有xmolH2,ymolO2,
则有$\frac{2x+32y}{x+y}$=17,
解之得x:y=1:1,
则ω(H2)=$\frac{1×2}{1×2+1×32}$×100%=5.88%,故B错误;
C.将标况下22.4L的HCl气体溶于1 L水中,溶液的体积不等于水的体积,所以无法计算溶液的物质的量浓度,故C错误;
D.1mL 3mol/L的K2SO4溶液和100mL 1mol/L的Al2(SO4)3溶液,SO42-浓度相同均为3mol/L,故D正确.
故选D.
点评 本题考查混合物的计算、物质的量的有关计算,题目难度不大,本题注意相对密度的运用,明确物质的量的有关计算公式是解题的关键,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
20. 硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.
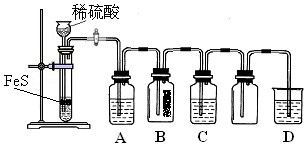
(1)某化学小组设计了制取H2S并验证其性质的实验,如图所示.A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液.
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为H2S+CuSO4=CuS↓+H2SO4.
②B中的现象是蓝色石蕊试纸变红.
③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为H2S+2Fe3+=S↓+2H++2Fe2+.
④D中盛放的试剂可以是d(填标号).
a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
已知:电离平衡常数:H2S Ka1=1.3×10-7;Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在酸性(或酸性较强)条件下,+4价硫的化合物可以氧化-2价硫的化合物.
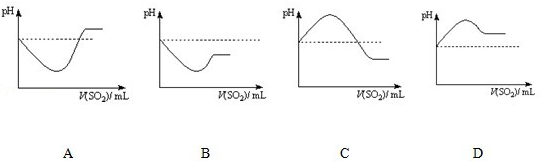
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是C(填序号).
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应.
 硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为H2S+CuSO4=CuS↓+H2SO4.
②B中的现象是蓝色石蕊试纸变红.
③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为H2S+2Fe3+=S↓+2H++2Fe2+.
④D中盛放的试剂可以是d(填标号).
a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在酸性(或酸性较强)条件下,+4价硫的化合物可以氧化-2价硫的化合物.
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是C(填序号).

(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应.
1.室温下,下列各组离子能大量共存的是( )
| A. | 稀硫酸中:K+、Mg2+、AlO2-、SO42- | |
| B. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | KW/c(H+)═10-13溶液中:Fe3+、NH4+、Mg2+、SO42- | |
| D. | 通大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
18.在同温同压下,有同质量的气体甲与乙,已知此时甲的体积小于乙的体积.则下列说法正确的是( )
| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的摩尔体积比乙的摩尔体积小 | |
| C. | 甲的相对分子质量比乙的相对分子质量大 | |
| D. | 甲的物质的量比乙的物质的量少 |
5.下列操作,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2
②向NaAlO2胶体中逐滴加入过量的稀盐酸
③氢氧化钡溶液中缓慢通入二氧化硫至过量
④向硅酸钠溶液中逐滴加入过量的盐酸.
①向饱和碳酸钠溶液中通入过量的CO2
②向NaAlO2胶体中逐滴加入过量的稀盐酸
③氢氧化钡溶液中缓慢通入二氧化硫至过量
④向硅酸钠溶液中逐滴加入过量的盐酸.
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
2.在一恒温、恒容的密闭容器中发生反应A(s)+2B(g)?C(g)+D(g),当下列物理量不再变化时,能够表明该反应已达平衡状态的是( )
| A. | 混合气体的压强 | B. | D的物质的量浓度 | ||
| C. | A的物质的量浓度 | D. | 气体的总物质的量 |
19.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,44.8 LH2O含有的水分子数为2NA | |
| B. | 88gC02含有的C02分子数为2NA | |
| C. | 46gNO2气体含有的氧原子数为NA | |
| D. | 1mol的任何气体中都含有NA个原子 |
20.某元素原子的核外M层电子数是4,该原子核内的质子数是( )
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |