题目内容
下列离子方程式书写正确的是( )
| A、将少量的H2S气体通入硫酸铜溶液中:H2S+Cu2+=CuS↓+2H+ |
| B、将NO2气体通入水中:2NO2+H2O=NO3-+NO↑+2H+ |
| C、ICl 和Cl2的化学性质相似,将ICl通入KOH溶液中:ICl+2OH-=I-+ClO-+H2O |
| D、往100ml 1.5mol/L的FeBr2 溶液中通入0.15mol Cl2:2Br-+Cl2=Br2+2Cl- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.将少量的H2S气体通入硫酸铜溶液中,反应生成硫化铜沉淀和硫酸;
B.电荷不守恒;
C.氯化碘中,碘显+1价,氯显-1价;
D.二价铁离子还原性强于溴离子,氯气先氧化二价铁离子.
B.电荷不守恒;
C.氯化碘中,碘显+1价,氯显-1价;
D.二价铁离子还原性强于溴离子,氯气先氧化二价铁离子.
解答:
解:A.将少量的H2S气体通入硫酸铜溶液中,离子方程式:H2S+Cu2+=CuS↓+2H+,故A正确;
B.将NO2气体通入水中,离子方程式:3NO2+H2O=2NO3-+NO↑+2H+,故B错误;
C.ICl 和Cl2的化学性质相似,将ICl通入KOH溶液中,离子方程式:ICl+2OH-=Cl-+IO-+H2O,故C错误;
D.往100ml 1.5mol/L的FeBr2 溶液中通入0.15mol Cl2,离子方程式:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故D错误;
故选:A.
B.将NO2气体通入水中,离子方程式:3NO2+H2O=2NO3-+NO↑+2H+,故B错误;
C.ICl 和Cl2的化学性质相似,将ICl通入KOH溶液中,离子方程式:ICl+2OH-=Cl-+IO-+H2O,故C错误;
D.往100ml 1.5mol/L的FeBr2 溶液中通入0.15mol Cl2,离子方程式:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故D错误;
故选:A.
点评:本题考查了离子方程式的书写,明确反应的实质是解题关键,注意反应物用量对反应的影响,选项D为易错选项.

练习册系列答案
相关题目
向xmL2.0mol/L的盐酸中投入ag镁铝合金,金属完全溶解,再加入ymL1.0mol/L的NaOH 溶液沉淀达到最大值,且质量为(a+1.7)g,则下列说法不正确的是( )
| A、a的取值范围为0.9g<a<1.2g |
| B、镁铝合金与盐酸反应时转移电子的数目为0.1NA |
| C、镁铝合金与盐酸反应产生H2的体积在常温常压下大于1.12L |
| D、x=2y |
 香豆素又称双呋精环,英文名称coumanin,天然存在于黑香豆,香蛇鞭菊、兰花等植物中,是一种重要的香料,还可用作抗凝血剂.香豆素-4由C、H、O三种元素组成,分子球棍模型如下图所示.下列有关叙述错误的是( )
香豆素又称双呋精环,英文名称coumanin,天然存在于黑香豆,香蛇鞭菊、兰花等植物中,是一种重要的香料,还可用作抗凝血剂.香豆素-4由C、H、O三种元素组成,分子球棍模型如下图所示.下列有关叙述错误的是( )| A、分子中含有不同的含氧宫能团 |
| B、能发生水解反应,但不能使酸性KMn2O4溶液褪色 |
| C、能与H2发生加成反应 |
| D、1mol香豆素-4最多能与3molNaOH反应 |
 5℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法不正确的是( )
5℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法不正确的是( )| A、B点的横坐标a>10 |
| B、滴加前盐酸的物质的量浓度为0.1mol?L-1 |
| C、A、B间的任一点,溶液都有c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定大于C点的pH |

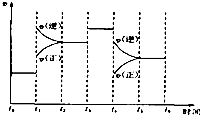 已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.
