题目内容
 5℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法不正确的是( )
5℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法不正确的是( )| A、B点的横坐标a>10 |
| B、滴加前盐酸的物质的量浓度为0.1mol?L-1 |
| C、A、B间的任一点,溶液都有c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定大于C点的pH |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:一水合氨为弱电解质,由图象知,盐酸浓度为0.1moL/L,A点溶液呈酸性,B点呈中性,氨水应稍过量,C点呈碱性,根据溶液的酸碱性及电荷守恒确定离子浓度关系.
解答:
解:A.如a=10,盐酸和氨水恰好反应生成氯化铵,水解呈酸性,而B点呈中性,则氨水应稍过量,故A正确;
B.由图象可知,加入氨水之前,溶液pH=1,则盐酸浓度为0.1moL/L,故B正确;
C,加入氨水少量时,c(H+)>c(NH4+),故C错误;
D.如果将氨水换为NaOH溶液,则滴加20mL时,氢氧化钠过量,溶液碱性更强,pH更大,故D正确.
故选C.
B.由图象可知,加入氨水之前,溶液pH=1,则盐酸浓度为0.1moL/L,故B正确;
C,加入氨水少量时,c(H+)>c(NH4+),故C错误;
D.如果将氨水换为NaOH溶液,则滴加20mL时,氢氧化钠过量,溶液碱性更强,pH更大,故D正确.
故选C.
点评:本题考查酸碱的混合以及离子浓度的大小比较,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意一水合氨为弱电解质的特点.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
下列离子方程式书写正确的是( )
| A、将少量的H2S气体通入硫酸铜溶液中:H2S+Cu2+=CuS↓+2H+ |
| B、将NO2气体通入水中:2NO2+H2O=NO3-+NO↑+2H+ |
| C、ICl 和Cl2的化学性质相似,将ICl通入KOH溶液中:ICl+2OH-=I-+ClO-+H2O |
| D、往100ml 1.5mol/L的FeBr2 溶液中通入0.15mol Cl2:2Br-+Cl2=Br2+2Cl- |
下列有关实验装置进行的相应实验,能达到实验目的是( )
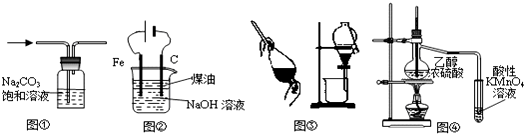

| A、图①除去CO2中的HCl |
| B、图②装置制备Fe(OH)2并能较长时间观察其颜色 |
| C、图③装置可用于分离C2H5OH和H2O的混合物 |
| D、图④证明CH3CH2OH发生消去反应生成了乙烯 |
下列叙述正确的是( )
| A、常温时,某溶液中由水电离出来的c(H+ )和c(OH- )的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO4 2- | ||
B、常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中
| ||
| C、油脂、淀粉和蛋白质在一定条件下都能发生水解反应 | ||
| D、SiO2和Al2O3都既能与酸反应,又能与碱反应,二者都属于两性氧化物 |
青海昆仑玉被定为08北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石的化学成份为Ca2Mg5Si8O22(OH)2.下列有关说法不正确的是( )
| A、透闪石的化学式写成氧化物的形式为:2CaO?5MgO?8SiO2?H2O |
| B、透闪石的化学式写成硅酸盐的形式为:2CaSiO3?5MgSiO3?H2SiO3 |
| C、透闪石中Mg元素的质量分数是Ca元素质量分数的2倍 |
| D、透闪石中还可能有少量的Al代替Mg,Na、K、Mn代替Ca、Mg等 |
一定温度下,向aL的密闭容器中加入2mol NO2(g),发生如下反应:2NO2?2NO+O2,此反应达到平衡的标志是( )
| A、单位时间内生成2n mol NO同时生成2n mol NO2 |
| B、混合气体中NO2、NO和O2的物质的量之比为2﹕2﹕1 |
| C、单位时间内生成2n mol NO同时生成n mol O2 |
| D、混合气体的颜色变浅 |
下列指定微粒的个数比为2:1的是( )
| A、Na2CO3溶液中的阳离子和阴离子 |
| B、21H原子中的中子和质子 |
| C、Be2+离子中的质子和电子 |
| D、Na2O2固体中的阴离子和阳离子 |
 如图为10mL一定物质的量浓度的盐酸(HCl),用一定浓度的NaOH溶液滴定的图示,依据图示推出HCl和NaOH的物质的量浓度是( )
如图为10mL一定物质的量浓度的盐酸(HCl),用一定浓度的NaOH溶液滴定的图示,依据图示推出HCl和NaOH的物质的量浓度是( )