题目内容
12.某同学用中和滴定法测定某烧碱样品的纯度,实验步骤如下:用中和滴定法测定某烧碱样品的纯度.有以下步骤:
Ⅰ、配制待测液:用托盘天平称量5.00g烧碱样品(杂质不与盐酸反应),配成1000mL溶液;
Ⅱ、滴定:取20.00mL所配待测液,用0.1mol.L-1的盐酸标准溶液进行滴定,达到滴定终点后,重复此操作两次;
Ⅲ、记录数据如下表:
| 测定序号 | 待测溶液体积 (mL) | 所耗盐酸标准溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.2 | 21.32 |
| 3 | 20.00 | 1.3 | 21.50 |
(1)配制待测液时,除烧杯、玻璃杯、胶头滴管外,还需要的主要玻璃仪器有1000mL容量瓶
(2)盛装0.1mol.L-1的盐酸标准溶液应该使用酸式滴定管,滴定时眼睛应注意观察:锥形瓶中溶液颜色的变
(3)滴定时如果用甲基橙做指示剂,达到滴定的标志是溶液由黄色变为橙色,且半分钟不变色
(4)下列操作会造成测定结果偏高的是B(填字母序号)
A.用蒸馏水冲洗锥形瓶;
B.在滴定过程中不慎将数滴酸液滴在锥形瓶外;
C.读数时,滴定前仰视,滴定后俯视.
(5)计算烧碱样品的纯度是80.8%.
分析 (1)根据配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作确定需要的仪器;
(2)酸或者强氧化性物质要用酸式滴定管盛,碱用碱式滴定管;两眼注视锥形瓶中溶液颜色的变化,以判定滴定终点;
(3)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)先分析数据的有效性,求出消耗盐酸的平均体积,然后根据关系式NaOH~HCl求出氢氧化钠的物质的量,再计算烧碱样品的纯度;
解答 解:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的玻璃仪器为:烧杯、玻璃棒、1000mL容量瓶、胶头滴管;
故答案为:1000mL容量瓶;
(2)盛装0.1mol.L-1的盐酸标准溶液应该使用酸式滴定管,滴定时眼睛应注意观察锥形瓶中溶液颜色的变化;
故答案为:酸式;锥形瓶中溶液颜色的变化;
(3)锥形瓶中为碱性溶液加甲基橙为黄色,当达到滴定终点时,溶液由黄色变为橙色,且半分钟不变色;
故答案为:溶液由黄色变为橙色,且半分钟不变色;
(4)A.若滴定前用蒸馏水冲洗锥形瓶,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)无影响,故A错误;
B.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,知c(待测)偏大,故B正确;
.读数时,若滴定前仰视,滴定后俯视,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故C错误;
故选B;
(5)三次消耗盐酸体积分别为:20.78ml-0.50ml=20.28ml、21.32ml-1.20ml=20.12ml;21.50ml-1.3ml=20.2ml,三次数据均有效,盐酸的平均体积为20.20mL,原溶液n(NaOH)=50×n(HCl)=50×0.10 mol/L×20.20mL×10-3=0.101mol,所以烧碱的纯度为$\frac{40×0.101}{5}$×100%=80.8%;
故答案为:80.8%.
点评 本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的原理、步骤、方法以及注意事项,把握实验基本操作.

| A. | 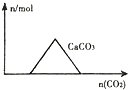 向Ca(OH)2和NaOH的混合溶液中通入CO2 | |
| B. | 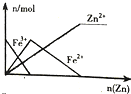 向FeCl3溶液中加入锌粉 | |
| C. |  向NaOH溶液中通入CO2 | |
| D. | 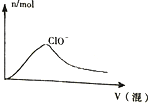 HCl与Cl2的混合通入NaOH溶液中 |
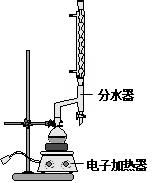
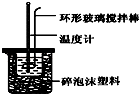 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:| 实验次数 | 起始温度t1/℃ | 起始温度t1/℃ | 终止温度t2/℃ |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=-56.8kJ/mol[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].如改用0.6mol/L的盐酸进行实验,其他情况不变,则实验中测得的“中和热”数值将不变(填“偏大”、“偏小”、“不变”).其理由是放出的热量多,生成的水也多,但中和热不变.
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较低
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
已知:
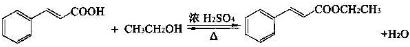
| 名称 | 相对分子质量 | 原色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 肉桂酸 | 148 | 白色晶体 | 300 | 1.2475 |
| 肉桂酸乙酯 | 176 | 无色油状液体 | 271.5 | 1.0491 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
①在圆底烧瓶中加入14.80g肉桂酸,25mL95%的乙醇,20mL环己烷和4mL浓硫酸,混合均匀并加入沙粒,加热回流2h,至分水器中水层不再明显增加,停止加热,冷却至室温.
②将烧瓶内反应液倒入盛有适量水的烧杯中,加入Na2CO3,用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入少量无水MgSO4固体,静置,过滤,对滤液进行蒸馏,低温蒸出乙醇、乙醚和环已烷后,继续升温,接收271~273℃的馏分.
③检验合格后,测得产品质量为13.60g.
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最合适的是C(填入正确选项前的字母)
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中控制加热回流温度的范围A(填入正确选项前的字母)
A.65~70℃B.78.3~80.8℃C.80.8~271.5℃D.271.5~300℃
(3)步骤②中加入NaCO3的作用是除去过量的硫酸和肉桂酸,加入无水MgSO4固体的作用是除去产品中微量的水.
(4)关于该实验的操作叙述正确的是B.
A.冷凝管中的冷却水从上口进下口出,与管内蒸气形成逆流
B.使用分水器时,先加水接近支管口,随着加热回流,及时打开活塞放出少量的水
C.萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的
D.静置分层后,打开活塞,先放出有机层,再弃去水层
(5)检验产品中是否含有肉桂酸的方法取少量粗产品固体溶于水,测溶于的pH.
(6)计算肉桂酸乙酯的产率77.27%.
| A. | 标准状况下,2.24L戊烷中存在的共价键总数为1.6NA | |
| B. | 23gNO2与N2O4的混合气体中含有的氮原子数为0.5NA | |
| C. | 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 1L0.1mol•L-1的NaH2PO4溶液中H2PO4-、HPO42-和PO43-离子数之和为0.1NA |
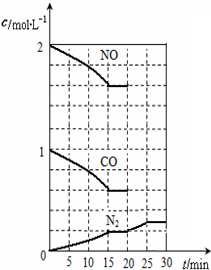 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法. 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题: