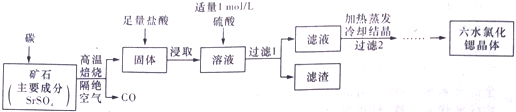
题目内容
5.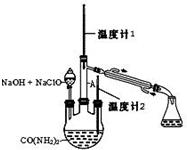 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl 请回答下列问题
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有BD(填标号).
A.容量瓶B.烧杯C.烧瓶D.玻璃棒
(2)将 Cl2通入 30%NaOH 溶液制备 NaClO 的化学方程式Cl2+2OH-=ClO-+Cl-+H2O.
(3)实验时,如果将 NaOH 和 NaClO 的混合溶液一次性加入三颈烧瓶,可能会造成的结果是反应生成的水合肼会被次氯酸钠氧化.
(4)实验时可根据温度计1温度为118.5℃判断 N2H4•H2O 开始蒸出.
已知:N2H4•H2O+2I2=N2↑+4HI+H2O.测定水合肼的质量分数可采用下列步骤:
①取 1.250g 试样,经溶解、转移、定容等步骤,配制 250mL 溶液.
②移取 10.00mL 溶液于锥形瓶中,滴入几滴淀粉溶液,加 20mL 水,摇匀.
③将 0.1000mol•L-1碘的标准溶液盛放在酸式滴定管中(填“酸式”或“碱式”)当溶液呈微黄色且半分钟内不消失停止滴定,消耗碘的标准溶液为 18.00mL,则产品中N2H4•H2O 的质量分数为90%.
分析 (1)用天平称量氢氧化钠质量,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌;
(2)氯气通入到盛有NaOH的锥形瓶中发生反应生成氯化钠、次氯酸钠和水;
(3)由N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl,可知水合肼(N2H4•H2O)具有还原性,易被次氯酸钠氧化;
(4)生成水合肼 (N2H4•H2O) 进行蒸馏分离,温度计1控制馏分水合肼蒸汽温度;
碘水具有强氧化性,能腐蚀碱式滴定管的橡胶;
N2H4•H2O完全反应,加入最后一滴碘溶液颜色不褪去,溶液呈微黄色且半分钟内不消失,说明滴定到达终点;
由N2H4+2I2=N2+4HI可知水合肼的物质的量,进而计算其质量分数.
解答 解:(1)用天平称量氢氧化钠质量,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌,所需玻璃仪器除量筒外,还有烧杯、玻璃棒,
故答案为:BD;
(2)氯气通入到盛有NaOH的锥形瓶中发生反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O;
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(3)由N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl,可知水合肼(N2H4•H2O)具有还原性,如果将 NaOH 和 NaClO 的混合溶液一次性加入三颈烧瓶,反应生成的水合肼会被次氯酸钠氧化,
故答案为:反应生成的水合肼会被次氯酸钠氧化;
(4)生成水合肼 (N2H4•H2O) 进行蒸馏分离,温度计1温度为118.5℃,判断 N2H4•H2O 开始蒸出,
碘单质具有氧化性,能腐蚀碱式滴定管的橡胶,则碘水应装在酸式滴定管中;
加入最后一滴碘溶液颜色不褪去,溶液呈微黄色且半分钟内不消失,说明滴定到达终点;
由N2H4+2I2=N2+4HI,可知250ml溶液中含有的物质的量=0.100mol/L×0.018L×$\frac{1}{2}$×$\frac{250mL}{10mL}$=0.0225mol,
水合肼(N2H4•H2O)的质量分数=$\frac{0.0225g×50g/mol}{1.250g}$×100%=90%,
故答案为:温度计1温度为118.5℃;酸式;溶液呈微黄色且半分钟内不消失;90%.
点评 本题考查物质制备实验,涉及溶液配制、物质含量测定、对操作的分析评价、滴定应用等,注意根据题目信息确定溶液添加顺序,较好的考查学生对实验原理的理解、知识迁移应用,难度中等.

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为0.1mol/(L•min).
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是AB(填编号).
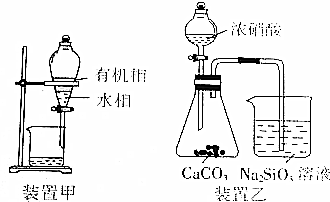
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加适量NaOH溶液并煮沸片刻 | |
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙进行实验,证明酸性:硝酸>碳酸>硅酸 | |
| D. | 探讨改变浓度研究反应“2Fe3++2I-?2Fe2++I2”中Fe3+和Fe2+的相互转化:向3mL 0.05mol•L-1Fe2(SO4)3溶液中加入3 mL 0.01mol•L-1 KI溶液,将所得黄色溶液等分成三份,第一份加入数滴0.01 mol•L-1AgNO3溶液,第二份加入1mL0.01mol•L-1FeSO4溶液,第三份加1mL水,观察并比较实验现象 |
| A. | 滴定前,未用NaOH溶液对锥形瓶进行润洗 | |
| B. | 滴定过程中,有少量盐酸滴在锥形瓶外 | |
| C. | 盛装盐酸前,未对酸式滴定管进行润洗 | |
| D. | 滴定终点时,对酸式滴定管俯视读数 |
| A. | 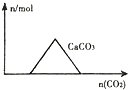 向Ca(OH)2和NaOH的混合溶液中通入CO2 | |
| B. | 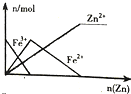 向FeCl3溶液中加入锌粉 | |
| C. |  向NaOH溶液中通入CO2 | |
| D. | 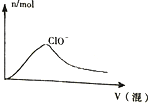 HCl与Cl2的混合通入NaOH溶液中 |
已知:
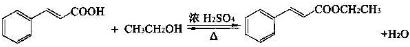
| 名称 | 相对分子质量 | 原色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 肉桂酸 | 148 | 白色晶体 | 300 | 1.2475 |
| 肉桂酸乙酯 | 176 | 无色油状液体 | 271.5 | 1.0491 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
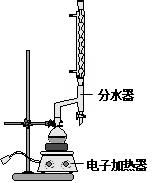
①在圆底烧瓶中加入14.80g肉桂酸,25mL95%的乙醇,20mL环己烷和4mL浓硫酸,混合均匀并加入沙粒,加热回流2h,至分水器中水层不再明显增加,停止加热,冷却至室温.
②将烧瓶内反应液倒入盛有适量水的烧杯中,加入Na2CO3,用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入少量无水MgSO4固体,静置,过滤,对滤液进行蒸馏,低温蒸出乙醇、乙醚和环已烷后,继续升温,接收271~273℃的馏分.
③检验合格后,测得产品质量为13.60g.
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最合适的是C(填入正确选项前的字母)
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中控制加热回流温度的范围A(填入正确选项前的字母)
A.65~70℃B.78.3~80.8℃C.80.8~271.5℃D.271.5~300℃
(3)步骤②中加入NaCO3的作用是除去过量的硫酸和肉桂酸,加入无水MgSO4固体的作用是除去产品中微量的水.
(4)关于该实验的操作叙述正确的是B.
A.冷凝管中的冷却水从上口进下口出,与管内蒸气形成逆流
B.使用分水器时,先加水接近支管口,随着加热回流,及时打开活塞放出少量的水
C.萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的
D.静置分层后,打开活塞,先放出有机层,再弃去水层
(5)检验产品中是否含有肉桂酸的方法取少量粗产品固体溶于水,测溶于的pH.
(6)计算肉桂酸乙酯的产率77.27%.
| A. | 加热后固体发黑 | B. | 坩埚沾有受热不分解的杂质 | ||
| C. | 加热时有少量晶体溅出 | D. | 晶体中混有受热不分解的杂质 |
| A. | 相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者 | |
| B. | NaHY的溶液中,离子浓度大小顺序为:c(Na+)>c(Y-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解离子方程式为:HY-+H2O?Y-+H3O+ | |
| D. | 在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同 |