题目内容
15.硫酸亚铁是重要的亚铁盐,广泛用于医药、化工和防腐等领域.(1)硫酸亚铁溶液呈酸性,其原因是Fe2++2H2O?Fe(OH)2+2H+(用离子方程式表示).
(2)硫酸亚铁在高温下会发生分解.某化学学习小组为探究硫酸亚铁在不同温度下的分解产物,进行了如下探究.请你完成下列问题:
【提出猜想】
①硫酸亚铁在不同温度下分解得到产物,可能是FeO和SO3(沸点44.8℃);也可能是Fe2O3、SO3和SO2.
【实验探究】
小组的同学根据猜想,设计了实验装置,并选择了可能用到的试剂如下:
A.品红溶液、B.KSCN溶液、C.BaCl2溶液 D.Ba(NO3)2溶液.
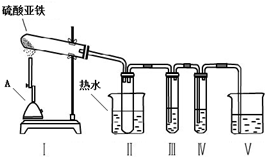
②为了得到较高温度,加热用的仪器A名称是酒精喷灯.
③为了检验气体产物中含有SO3,在装置Ⅲ应装的试剂是C(选填试剂序号),装置Ⅱ中装热水的作用是避免SO3冷却成液体.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 KSCN溶液(或B). | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加 2滴黄色K3[Fe(CN)6]溶液. | 产生蓝色沉淀 | 固体中含有FeO |
分析 (1)硫酸亚铁溶液中溶质为强酸弱碱盐,亚铁离子水解溶液显酸性;
(2)①已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;
②为了得到较高温度,加热用的仪器A为酒精喷灯;
③安全瓶的作用是可以防止倒吸;当温度高于44.8°C时三氧化硫为气体状态,装置III是检验是否有三氧化硫,装置IV是检验是否有二氧化硫,根据二者的性质选择试剂;
④检验三价铁离子用硫氰化钾溶液;检验二价铁离子用K3[Fe(CN)6]溶液;
⑤若生成的固体产物为Fe2O3和FeO,且其物质的量相等.依据氧化还原反应电子守恒计算分析判断,反应除生产铁的氧化物同时生成二氧化硫、三氧化硫气体,结合原子守恒配平书写化学方程式.
解答 解:(1)硫酸亚铁溶液呈酸性,其原因是亚铁离子水解溶液显酸性,离子方程式为:Fe2++2H2O?Fe(OH)2+2H+,
故答案为:Fe2++2H2O?Fe(OH)2+2H+;
(2)①已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2,
故答案为:SO2;
②固体分解需要较高的温度,为了得到较高温度,加热用的仪器A名称是酒精喷灯,
故答案为:酒精喷灯;
③装置III是检验是否有三氧化硫,可以选用C中的氯化钡溶液,如果有白色沉淀生成说明有三氧化硫;SO3的沸点是44.8°C,当温度高于44.8°C时三氧化硫为气体状态,把试管浸泡在50℃的热水浴中能防止SO3液化或凝固,产生的气体极易和溶液反应时,会产生倒吸,所以装置II的试管能防止溶液倒吸入装置Ⅰ中(或安全瓶),
故答案为:C;避免SO3冷却成液体;
④检验三价铁离子用硫氰化钾溶液,溶液变红色,证明有三价铁离子,进而说明固体产物中含有氧化铁;检验二价铁离子用K3[Fe(CN)6]溶液,溶液中生成蓝色沉淀,说明有二价铁离子,即证明固体产物中含有FeO;
故答案为:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| KSCN溶液(或B) | 溶液变成血红色 | |
| 产生蓝色沉淀 |
故答案为:3FeSO4$\frac{\underline{\;高温\;}}{\;}$ FeO+Fe2O3+SO2↑+2SO3↑.
点评 本题考查了物质存在和性质的实验探究方法和实验设计判断、物质检验实验设计和现象分析判断,氧化还原反应和盐类水解的分析应用是解题关键,题目难度中等.

| A. | 0.1mol丙烯中含有共价键的数目为0.6NA | |
| B. | 0.1mo Cl2全部溶于水后转移电子的数目为0.1NA | |
| C. | 标准状况下,2.24LSO3中含有氧原子的数目为0.3NA | |
| D. | 9.2g由乙醇和二甲醚(CH3OCH3)组成的混合物中含有氧原子的数目为0.2NA |
| A. | 25℃时,pH=4.5的硫酸溶液中c(H+) 是pH=5.5的磷酸中c(H+)的10倍 | |
| B. | 因为合金在潮湿的空气中易形成原电池,所以合金的耐腐蚀性都较差 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 常温下,2NO(g)+O2(g)?2NO2(g)能够自发进行,则该反应的△H<0 |
| A. | 0.1 mol/LCH3COONa溶液与0.1 mol/LCaCl2溶液等体积混合:c(Na+)+c(Ca2+)═c(CH3COO-)+c(CH3COOH)+2c(Cl- ) | |
| B. | 将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)═c(OH-)+c(CO32-)+c(NH3•H2O) | |
| C. | 0.1 mol/LCH3COONa溶液与0.1 mol/LHCl溶液混合至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-) | |
| D. | 0.2mol/L氨水与0.1 mol/LHCl溶液等体积混合:c(Cl-)+c(H+)═c(NH3•H2O)+c(OH-) |
| A. | 25℃时,pH=7的NH4Cl和NH3•H2O的混合溶液中,OH-数为10-7NA | |
| B. | 33.6 L NO2溶于足量的水得到的溶液中含有的NO3-数为NA | |
| C. | P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则1 mol该分子中含有的共价键数目是10NA | |
| D. | 18g的D2O与NA个-CH3具有相同的电子数 |
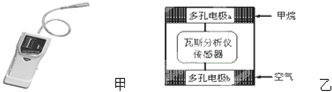
下列有关叙述正确的是( )
| A. | 电极b是正极,O2-由电极a流向电极b | |
| B. | 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a | |
| C. | 当固体电解质中有1 mol O2-通过时,电子转移4 mol | |
| D. | 电极a的反应式为:CH4+5O2--8e-═CO32-+2H2O |
| A. | 标准状况下,22.4L 水中所含原子总数为3NA | |
| B. | 1molNa2O2与足量CO2反应转移的电子数2NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| A. | 硅的非金属性比硫弱 | B. | 硅酸钠可溶于水 | ||
| C. | SiO2与氢氟酸能反应 | D. | 硅原子易失去或得到电子 |
| A. | 蛋白质和氨基酸 | B. | 淀粉和纤维素 | ||
| C. | 葡萄糖和果糖 | D. | 植物油和动物脂肪 |