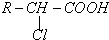题目内容
10.设NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 25℃时,pH=7的NH4Cl和NH3•H2O的混合溶液中,OH-数为10-7NA | |
| B. | 33.6 L NO2溶于足量的水得到的溶液中含有的NO3-数为NA | |
| C. | P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则1 mol该分子中含有的共价键数目是10NA | |
| D. | 18g的D2O与NA个-CH3具有相同的电子数 |
分析 A.依据溶液中电荷守恒分析判断,常温下氢离子浓度等于氢氧根离子浓度为10-7mol/L,容易体积不知不能计算微粒数;
B.气体温度压强不知不能计算物质的量;
C.根据“P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构”分析P4O6的分子结构,利用均摊法计算出1molP4O6分子含有的共价键数目;
D.n=$\frac{m}{M}$计算物质的量,D2O含10个电子,NA个-CH3具有9个电子.
解答 解:A.25℃时,pH=7的NH4Cl和NH3•H2O的混合溶液中,存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),常温下氢离子浓度等于氢氧根离子浓度为10-7mol/L,但容易体积不知不能计算氢氧根离子数,故A错误
B.气体温度压强不知,33.6 L NO2溶于物质的量不是1.5mol,故B错误;
C.P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,说明每个P与3个O形成3个P-O键,每个P形成的共价键为为:$\frac{1}{2}$×3;每个氧原子与两个P形成2个P-O共价键,每个氧原子形成的共价键数目为$\frac{1}{2}$×2=1mol,1molP4O6分子含有的共价键物质的量为:$\frac{3}{2}$mol×4+6×1mol=12mol,则1mol该分子中含有的共价键数目是12NA,故C错误;
D.n=$\frac{m}{M}$计算物质的量=$\frac{18g}{20g/mol}$=0.9mol,0.9molD2O含9个电子,NA个-CH3具有9个电子,18g的D2O与NA个-CH3具有相同的电子数,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的分析判断,主要是电解质溶液离子浓度大小、气体摩尔体积应用条件、微粒结构和化学键的计算,掌握基础是解题关键,题目难度中等.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案| A. | 化学变化一定会产生新的核素 | |
| B. | 明矾净水过程涉及化学变化 | |
| C. | 催化剂能改变化学反应的活化能和焓变 | |
| D. | 在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径: 途径a:Fe$\stackrel{H_{2}SO_{4}}{→}$H2$→_{△}^{Cu}$Cu 途径b:CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu 实际操作中,制得等质量的铜时,途径a和途径b消耗Fe的质量一定相等 |
| A. | 甲烷分子的球棍模型: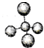 | B. | NH4Br的电子式: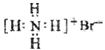 | ||
| C. | 氯原子的结构示意图: | D. | 邻羟基苯甲酸的结构简式: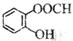 |
| A. | 高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O | |
| B. | 苯酚与碳酸钠溶液: +CO32-→ +CO32-→ +H2CO3 +H2CO3 | |
| C. | 等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |
| D. | 在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
(1)硫酸亚铁溶液呈酸性,其原因是Fe2++2H2O?Fe(OH)2+2H+(用离子方程式表示).
(2)硫酸亚铁在高温下会发生分解.某化学学习小组为探究硫酸亚铁在不同温度下的分解产物,进行了如下探究.请你完成下列问题:
【提出猜想】
①硫酸亚铁在不同温度下分解得到产物,可能是FeO和SO3(沸点44.8℃);也可能是Fe2O3、SO3和SO2.
【实验探究】
小组的同学根据猜想,设计了实验装置,并选择了可能用到的试剂如下:
A.品红溶液、B.KSCN溶液、C.BaCl2溶液 D.Ba(NO3)2溶液.
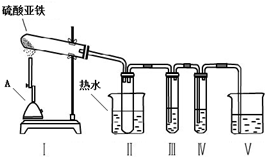
②为了得到较高温度,加热用的仪器A名称是酒精喷灯.
③为了检验气体产物中含有SO3,在装置Ⅲ应装的试剂是C(选填试剂序号),装置Ⅱ中装热水的作用是避免SO3冷却成液体.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 KSCN溶液(或B). | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加 2滴黄色K3[Fe(CN)6]溶液. | 产生蓝色沉淀 | 固体中含有FeO |
步骤一:制取FeCl2溶液.向0.1mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1.
实验二:向1mL FeCl2溶液中滴加2滴0.1mol•L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(1)用离子方程式表示步骤二中溶液变红的原因:2Fe2++H2O2+2H+═2Fe3++2H2O、Fe3++3SCN?Fe(SCN)3.
(2)甲探究步骤二中溶液褪色的原因:
Ⅰ.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
Ⅱ.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀.
Ⅲ.向2mL 0.1mol•L-1 FeCl3溶液中滴加2滴0.1mol•L-1KSCN溶液,变红,通入O2,无明显变化.
①实验I的说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应;
②实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能.
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-.
(3)甲直接用FeCl2•4H2O配制0.15mol•L-1的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去.进一步探究其原因:
Ⅰ.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无.测所配FeCl2溶液的pH,约为3.由此,乙认为红色不褪去的可能原因是H2O2将Fe2+氧化为Fe3+,pH增大促进Fe3+水解形成红色Fe(OH)3胶体.
Ⅱ.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-.乙利用上述部分试剂,通过实验排除了这一可能.乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i | 取2 mL BaCl2溶液,滴加2滴0.1 mol•L-1KSCN溶液和5滴5% H2O2溶液 | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1mol•L-1 FeCl3溶液 | 无明显现象 |
| A. | 该物质为有机物 | B. | 该物质为无机物 | ||
| C. | 该物质由三种元素组成 | D. | 该物质燃烧产物可能含CO2 |
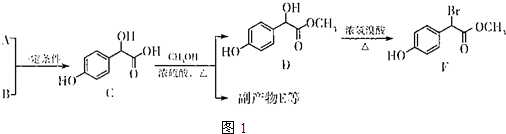
 .
. 中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.
中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.