题目内容
20.瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.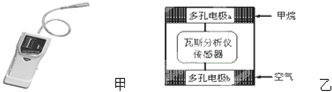
下列有关叙述正确的是( )
| A. | 电极b是正极,O2-由电极a流向电极b | |
| B. | 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a | |
| C. | 当固体电解质中有1 mol O2-通过时,电子转移4 mol | |
| D. | 电极a的反应式为:CH4+5O2--8e-═CO32-+2H2O |
分析 该装置是燃料电池,通入甲烷的电极a是负极、通入空气的电极b是正极,放电时,负极反应式为CH4+5O2--8e-═CO32-+2H2O,正极反应式为O2+4e-=2O2-,电子从负极沿导线流向正极,原电池内部阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答 解:A.该原电池中,正极上氧气得电子发生还原反应,所以通入空气的电极b是正极,内电路中阴离子向负极移动,所以O2-由电极b流向电极a,故A错误;
B.电子不进入原电池内部,内电路是通过阴阳离子定向移动形成电流,故B错误;
C.每个O原子得到2个电子生成O2-,所以当固体电解质中有1mol O2-通过时,电子转移2mol,故C错误;
D.a是负极,负极上甲烷失电子和氧离子反应生成碳酸根离子和水,电极反应式为CH4+5O2--8e-═CO32-+2H2O,故D正确;
故选D.
点评 本题考查了化学电源新型电池的原电池原理应用,主要理解电池电解质不是在水溶液中的氧化还原反应,电解质是固体,O2-可以在其中自由移动,是本题的关键.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
10.化学与环境和能源密切相关.下列说法不正确的是( )
| A. | 氢氧燃枓电池、铅蓄电池、硅太阳能电池都利用了原电池原理 | |
| B. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| C. | 为防止重金属等污染土壤和水体,废电池应回收综合利用 | |
| D. | 用可降解的“玉米塑料”制作一次性饭盒,能减少“白色污染” |
8.如图1所示是实验室中制取气体的一种简易装置.
(1)请简述检验它的气密性的方法关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好.
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)不溶于水的块状固体、不需要加热而反应生成的气体.
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.

(3)已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为2.95mol/L(计算结果保留两位小数).用若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有玻璃棒、烧杯和量筒.
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH$\stackrel{高温}{→}$2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是d.
a.HNO3的氧化性比KNO3弱 b.反应的温度不够
c.HNO3的热稳定性比KNO3差 d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等.请设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
(1)请简述检验它的气密性的方法关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好.
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)不溶于水的块状固体、不需要加热而反应生成的气体.
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.

(3)已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为2.95mol/L(计算结果保留两位小数).用若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有玻璃棒、烧杯和量筒.
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH$\stackrel{高温}{→}$2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是d.
a.HNO3的氧化性比KNO3弱 b.反应的温度不够
c.HNO3的热稳定性比KNO3差 d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等.请设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
15.硫酸亚铁是重要的亚铁盐,广泛用于医药、化工和防腐等领域.
(1)硫酸亚铁溶液呈酸性,其原因是Fe2++2H2O?Fe(OH)2+2H+(用离子方程式表示).
(2)硫酸亚铁在高温下会发生分解.某化学学习小组为探究硫酸亚铁在不同温度下的分解产物,进行了如下探究.请你完成下列问题:
【提出猜想】
①硫酸亚铁在不同温度下分解得到产物,可能是FeO和SO3(沸点44.8℃);也可能是Fe2O3、SO3和SO2.
【实验探究】
小组的同学根据猜想,设计了实验装置,并选择了可能用到的试剂如下:
A.品红溶液、B.KSCN溶液、C.BaCl2溶液 D.Ba(NO3)2溶液.
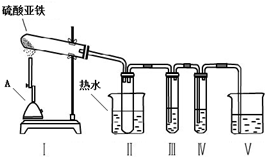
②为了得到较高温度,加热用的仪器A名称是酒精喷灯.
③为了检验气体产物中含有SO3,在装置Ⅲ应装的试剂是C(选填试剂序号),装置Ⅱ中装热水的作用是避免SO3冷却成液体.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
⑤若生成的固体产物为Fe2O3和FeO,且其物质的量相等.则反应的化学方程式为3FeSO4 $\frac{\underline{\;高温\;}}{\;}$FeO+Fe2O3+SO2↑+2SO3↑.
(1)硫酸亚铁溶液呈酸性,其原因是Fe2++2H2O?Fe(OH)2+2H+(用离子方程式表示).
(2)硫酸亚铁在高温下会发生分解.某化学学习小组为探究硫酸亚铁在不同温度下的分解产物,进行了如下探究.请你完成下列问题:
【提出猜想】
①硫酸亚铁在不同温度下分解得到产物,可能是FeO和SO3(沸点44.8℃);也可能是Fe2O3、SO3和SO2.
【实验探究】
小组的同学根据猜想,设计了实验装置,并选择了可能用到的试剂如下:
A.品红溶液、B.KSCN溶液、C.BaCl2溶液 D.Ba(NO3)2溶液.

②为了得到较高温度,加热用的仪器A名称是酒精喷灯.
③为了检验气体产物中含有SO3,在装置Ⅲ应装的试剂是C(选填试剂序号),装置Ⅱ中装热水的作用是避免SO3冷却成液体.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 KSCN溶液(或B). | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加 2滴黄色K3[Fe(CN)6]溶液. | 产生蓝色沉淀 | 固体中含有FeO |
12.牛肉和菠菜等食物中含有丰富的铁,这里的“铁”应理解为( )
| A. | 单质 | B. | 分子 | C. | 原子 | D. | 元素 |
9.出土的铜器文物表面有一层绿色的铜锈,铜锈的主要成分是( )
| A. | 碱式碳酸铜 | B. | 碳酸铜 | C. | 氢氧化铜 | D. | 氧化铜 |
 NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.
NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.
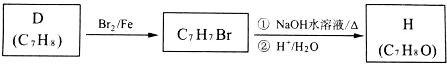
 .
.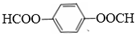 .
. 某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.