题目内容
6.下列有关说法正确的是( )| A. | 25℃时,pH=4.5的硫酸溶液中c(H+) 是pH=5.5的磷酸中c(H+)的10倍 | |
| B. | 因为合金在潮湿的空气中易形成原电池,所以合金的耐腐蚀性都较差 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 常温下,2NO(g)+O2(g)?2NO2(g)能够自发进行,则该反应的△H<0 |
分析 A.根据pH=-lgc(H+)计算;
B.不锈钢等耐腐蚀;
C.催化剂不能使平衡移动;
D.根据反应自发进行的判断依据:△H-△S<0解答.
解答 解:A.pH=4.5的硫酸溶液中c(H+)为10-4.5mol/L,pH=5.5的磷酸中c(H+)为10-5.5mol/L,前者是后者的10倍,故A正确;
B.不是所有的合金耐腐蚀都很差,例如钛合金、铝合金等具有很好的抗腐蚀性能,故B错误;
C.催化剂不能使平衡移动,只改变反应速率,故C错误;
D.由方程式2NO(g)+O2(g)?2NO2(g)可知该反应△S<0,要使△H-△S<0,必须满足△H<0,故D正确.
故选AD.
点评 本题考查较为综合,涉及金属的腐蚀与防护,pH的计算以及反应方向判据,为高考常见题型,考查学生对基本知识的掌握程度,难度不大.

练习册系列答案
相关题目
16.在常温常压下,取下列4种气态烃各1mol,分别在足量的氧气中燃烧,其中消耗氧气最多的是( )
| A. | CH4 | B. | C2H6 | C. | C4H10 | D. | C3H8 |
14.下列物质既能发生消去反应又能被氧化成醛的是( )
| A. | (CH3)3CCH2OH | B. |  | C. |  | D. | (CH3)2CBrCH2OH |
1.下列说法正确的是( )
| A. | 化学变化一定会产生新的核素 | |
| B. | 明矾净水过程涉及化学变化 | |
| C. | 催化剂能改变化学反应的活化能和焓变 | |
| D. | 在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径: 途径a:Fe$\stackrel{H_{2}SO_{4}}{→}$H2$→_{△}^{Cu}$Cu 途径b:CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu 实际操作中,制得等质量的铜时,途径a和途径b消耗Fe的质量一定相等 |
18.化学学科需要借助化学语言来描述.下列化学用语正确的是( )
| A. | 甲烷分子的球棍模型: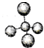 | B. | NH4Br的电子式: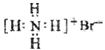 | ||
| C. | 氯原子的结构示意图: | D. | 邻羟基苯甲酸的结构简式: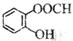 |
15.硫酸亚铁是重要的亚铁盐,广泛用于医药、化工和防腐等领域.
(1)硫酸亚铁溶液呈酸性,其原因是Fe2++2H2O?Fe(OH)2+2H+(用离子方程式表示).
(2)硫酸亚铁在高温下会发生分解.某化学学习小组为探究硫酸亚铁在不同温度下的分解产物,进行了如下探究.请你完成下列问题:
【提出猜想】
①硫酸亚铁在不同温度下分解得到产物,可能是FeO和SO3(沸点44.8℃);也可能是Fe2O3、SO3和SO2.
【实验探究】
小组的同学根据猜想,设计了实验装置,并选择了可能用到的试剂如下:
A.品红溶液、B.KSCN溶液、C.BaCl2溶液 D.Ba(NO3)2溶液.
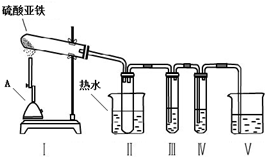
②为了得到较高温度,加热用的仪器A名称是酒精喷灯.
③为了检验气体产物中含有SO3,在装置Ⅲ应装的试剂是C(选填试剂序号),装置Ⅱ中装热水的作用是避免SO3冷却成液体.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
⑤若生成的固体产物为Fe2O3和FeO,且其物质的量相等.则反应的化学方程式为3FeSO4 $\frac{\underline{\;高温\;}}{\;}$FeO+Fe2O3+SO2↑+2SO3↑.
(1)硫酸亚铁溶液呈酸性,其原因是Fe2++2H2O?Fe(OH)2+2H+(用离子方程式表示).
(2)硫酸亚铁在高温下会发生分解.某化学学习小组为探究硫酸亚铁在不同温度下的分解产物,进行了如下探究.请你完成下列问题:
【提出猜想】
①硫酸亚铁在不同温度下分解得到产物,可能是FeO和SO3(沸点44.8℃);也可能是Fe2O3、SO3和SO2.
【实验探究】
小组的同学根据猜想,设计了实验装置,并选择了可能用到的试剂如下:
A.品红溶液、B.KSCN溶液、C.BaCl2溶液 D.Ba(NO3)2溶液.

②为了得到较高温度,加热用的仪器A名称是酒精喷灯.
③为了检验气体产物中含有SO3,在装置Ⅲ应装的试剂是C(选填试剂序号),装置Ⅱ中装热水的作用是避免SO3冷却成液体.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 KSCN溶液(或B). | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加 2滴黄色K3[Fe(CN)6]溶液. | 产生蓝色沉淀 | 固体中含有FeO |
16.下列物质中,不能与稀盐酸反应的有( )
| A. | Cu | B. | CaCO3 | C. | Zn | D. | AgNO3 |
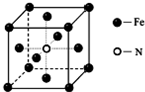 NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.
NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.