题目内容
2.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3(s)+3H2(g)$\stackrel{高温}{?}$W (s)+3H2O (g) 请回答下列问题:(1)上述反应的化学平衡常数表达式为K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随着温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)?W(s)+2H2O (g)△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O (g)△H=-137.9kJ?mol-1
则WO2(s)?WO2(g)的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2 (g) $?_{约3000℃}^{1400℃}$WI4 (g).下列说法正确的有a、b.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比,注意固体、纯液体不需要写出;
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,假定H2与水蒸气的物质的量分别为2mol、3mol,再根据转化率定义计算;
随温度的升高,H2与水蒸气的体积比减小,说明平衡向正反应移动;
(3)由表中主要成分与温度关系可知,第一阶段反应为WO3与H2反应是W2O5,同时还生成H2O,配平书写方程式;根据三个阶段的方程式进行计算三个阶段消耗H2物质的量之比;
(4)已知:①WO2(s)+2H2(g)═W(s)+2H2O (g)△H=+66.0kJ•mol-1
②WO2(g)+2H2(g)═W(s)+2H2O (g)△H=-137.9kJ•mol-1
根据盖斯定律,①-②可得:WO2(s)═WO2(g),反应热也进行相应的运算;
(5)由化学方程式知,挥发的W与I2结合形成气态WI4,由于气体运动的结果,WI4会与还没有挥发的W接触,在高温下WI4分解生成的W附着在还没有挥发的W上,灯管壁温度较低,WI4不会分解,升高温度,正逆反应速率都加快.
解答 解:(1)反应WO3(s)+3H2(g)$\stackrel{高温}{?}$W (s)+3H2O (g)的平衡常数表达式为:K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$,
故答案为:K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$;
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,故H2的平衡转化率为:$\frac{3mol}{2mol+3mol}$×100%=60%,
升高温度,H2与水蒸气的体积比减小,说明升温时平衡向右移动,故正反应为吸热反应,
故答案为:60%;吸热;
(3)由表中主要成分与温度关系可知,第一阶段反应为WO3与H2反应是W2O5,同时还生成H2O,反应方程式为:2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O,假定有2molWO3,由2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O、W2O5+H2$\frac{\underline{\;高温\;}}{\;}$2WO2+H2O、2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O可知,三个阶段消耗的氢气的物质的量之比为1mol:1mol:2mol×2=1:1:4,
故答案为:2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;1:1:4;
(4)已知:①WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H=+66.0kJ•mol-1
②WO2 (g)+2H2?W (s)+2H2O (g);△H=-137.9kJ•mol-1
根据盖斯定律①-②得:WO2 (s)?WO2 (g),△H=66.0kJ•mol-1-(-137.9kJ•mol-1)=+203.9 kJ•mol-1,
故答案为:+203.9 kJ•mol-1;
(5)由所给化学方程式知,挥发的W与I2结合形成气态WI4,由于气体运动的结果,WI4会与还没有挥发的W接触,在高温下WI4分解生成的W及I2,生成W附着在还没有挥发的W上,灯管内的I2可循环使用,故a、b正确;灯管壁温度较低,WI4不会分解,故c错误;升高温度,也能加快W与I2的反应速率,故d错误;
故答案为:a、b.
点评 本题考查较为综合,为高频考点,涉及化学平衡常数的书写、反应热的计算、化学平衡移动原理、化学平衡计算等,题目难度中等,注意掌握化学平衡及其影响,明确盖斯定律的内容及应用方法,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 生成1 mol NaNO3需消耗0.4 mol KMnO4 | |
| B. | 反应过程中溶液的pH减小 | |
| C. | 该反应中NO${\;}_{2}^{-}$被还原 | |
| D. | X可以是盐酸 |
| A. | SiO2通常用于通讯行业 | |
| B. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;而碳酸钠可作医疗上治疗胃酸过多的一种药剂 | |
| C. | 明矾可用作净水剂 | |
| D. | 金属钠可用于冶炼钛等金属 |
| t/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为900℃
(4)900℃时,在1L固定的密闭容器中,加入2mol CO2和1mol H2,反应进行一段时间后,测得CO的浓度为0.5mol/L,则此时该反应是否达到平衡状态否(填“是”或“否”),此时v(正)大于v(逆)(填“大于”“小于”或“等于”),达到平衡时CO2的转化率为33.3%.
(5)化学平衡移动原理同样也适用于溶液中的平衡,已知在氨水中存在下列平衡:
NH3+H2O?NH3•H2O?NH4++OH-
①向氨水中加入MgCl2固体时,平衡向右移动(填“左”或“右”),溶液中OH-的浓度B(填序号,下同),NH4+离子的浓度A.
A.变大B.变小C.不变
②向浓氨水中加入少量的NaOH固体,上述平衡向左移动(填“左”或“右”),溶液中OH-的浓度A(填序号,下同),NH4+离子的浓度B.
A.变大B.变小C.不变.
 【化学-选修2化学与技术】
【化学-选修2化学与技术】许多含碳、氢物质是重要的化工原料.
(1)某新型储氢合金(化学式为Mg17Al12)的储氢原理为Mg17Al12+17H2═17MgH2+12Al,此变化中还原产物是MgH2(填化学式).
(2)草酸的钙盐、钡盐、镁盐难溶于水.已知C2O3是无色无味气体,可溶于水生成草酸(H2C2O4),写出它溶于足量Ba(OH)2溶液发生反应的化学方程式C2O3+Ba(OH)2=BaC2O4↓+H2O.
(3)已知:几个热化学方程式如下:
①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
| 化学键 | C≡O | O═O | C═O(CO2中) |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
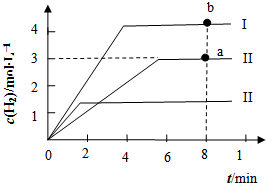
(4)向2L恒容密闭容器中充入3mol CH4(g)、4mol H2O(g),发生反应制备CO、H2,测得温度为t℃时,容器内H2的物质的量浓度(mol•L-1)随时间的变化如图中II曲线所示.图中I、III分别表示相对于II仅改变反应条件后,c(H2)随时间的变化.
①若曲线I仅代表改变一种条件后的情况,则改变的条件可能是升温;a、b两点用CO浓度变化表示的净反应速率关系为a<b;
②曲线II对应反应的平衡常数K为54.该温度下,若将等物质的量浓度的CH4(g)、H2O(g)、CO(g)、H2(g)混合充入该容器中,则开始进行方向是无法确定(填:向左、向右、平衡或无法确定).
③曲线III相对于曲线II改变的条件是B.
A.降低温度 B.使用催化剂、降低温度 C.加压.
| A. | 2H2 (g)+O2(g)=2H2O(l);△H=-484kJ•mol-1 | |
| B. | 2H2 (g)+O2(g)=2H2O(g);△H=+484kJ•mol-1 | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | |
| D. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 |
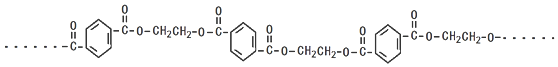
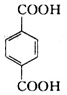 ,分子较小的单体含氧官能团名称是羟基.
,分子较小的单体含氧官能团名称是羟基.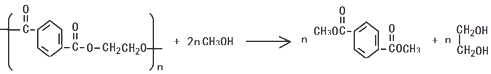 .
.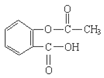 )的原料.
)的原料.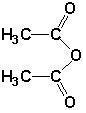 )反应生成阿司匹林的化学方程式:
)反应生成阿司匹林的化学方程式: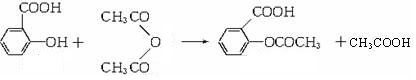 .
. ,该同分异构体符合以下条件:
,该同分异构体符合以下条件:
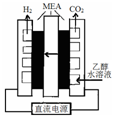 氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:
氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下: