题目内容
11.已知在常温常压下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )| A. | 2H2 (g)+O2(g)=2H2O(l);△H=-484kJ•mol-1 | |
| B. | 2H2 (g)+O2(g)=2H2O(g);△H=+484kJ•mol-1 | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | |
| D. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 |
分析 A.是生成水蒸气,而不是液态水;
B.反应为放热反应,焓变值小于0;
C.放热反应,焓变值小于0;
D.1mol氢气燃烧生成水蒸气放出242kJ热量,则分解1mol水蒸气生成1mol氢气与$\frac{1}{2}$mol氧气吸收热量为242KJ;
解答 解:A.反应生成的是水蒸气,而不是液态水,所以热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,故A错误;
B.2mol氢气燃烧生成水蒸气放出484kJ热量,焓变值为小于0,所以热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,故B错误;
C.2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,所以H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol,故C错误;
D..1mol氢气燃烧生成水蒸气放出242kJ热量,则分解1mol水蒸气生成1mol氢气与$\frac{1}{2}$mol氧气吸收热量为242KJ,反应热化学方程式:H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1,故D正确;
故选:D.
点评 本题主要考查学生热化学方程式的书写原则,准确书写反应的化学方程式,注明反应物聚集状态,判断反应放出或者吸收热量是解题关键,该题型是现在高考的热点,题目难度不大.

练习册系列答案
相关题目
12.如表中实验“操作和现象”与“结论或目的一均正确的一组是( )
| 操作和现象 | 结论或目的 | |
| A | 向纯碱中滴加足量浓盐酸,将所得气体通入硅酸钠溶液中,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
| C | 取少量Fe(NO3)2试样加水溶液后加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | 目的:将不溶于酸的沉淀转化为易溶于酸的沉淀 |
| A. | A | B. | B | C. | C | D. | D |
2.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3(s)+3H2(g)$\stackrel{高温}{?}$W (s)+3H2O (g) 请回答下列问题:
(1)上述反应的化学平衡常数表达式为K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随着温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为1:1:4.
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)?W(s)+2H2O (g)△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O (g)△H=-137.9kJ?mol-1
则WO2(s)?WO2(g)的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2 (g) $?_{约3000℃}^{1400℃}$WI4 (g).下列说法正确的有a、b.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
(1)上述反应的化学平衡常数表达式为K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随着温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)?W(s)+2H2O (g)△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O (g)△H=-137.9kJ?mol-1
则WO2(s)?WO2(g)的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2 (g) $?_{约3000℃}^{1400℃}$WI4 (g).下列说法正确的有a、b.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
19.亚硝酸氯(ClNO)是有机合成中的重要试剂.可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g)
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+Cl2(g)?2ClNO(g)K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O):
则2NO(g)+Cl2(g)?2ClNO(g)反应的△H和a的关系为△H=289-2akJ/mol.
(3)300℃时.2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k•cn(ClNO),
测得速率和浓度的关系如下表:
n=2;k=4.0×10-8L/(mo1•s)(注明单位).
(4)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
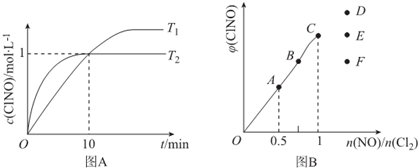
①该反应的△H<0(填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=0.1mol/(L•min),
③T2时该反应的平衡常数K=2
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{l}_{2})}$=的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点,当$\frac{n(NO)}{n(C{l}_{2})}$=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的D点.
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+Cl2(g)?2ClNO(g)K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
(3)300℃时.2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k•cn(ClNO),
测得速率和浓度的关系如下表:
| 序号 | c(ClNO)/mol.L-1 | v/mol.L-1•s-1 |
| ① | 0.30 | 3.60×10${\;}^{-{9}^{\;}}$ |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
(4)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:

①该反应的△H<0(填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=0.1mol/(L•min),
③T2时该反应的平衡常数K=2
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{l}_{2})}$=的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点,当$\frac{n(NO)}{n(C{l}_{2})}$=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的D点.
6.下列氧化还原反应中电子转移数目及方向都正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
16.某无色溶液中,先加入足量稀盐酸,无任何变化,再加入BaCl2(aq),产生白色沉淀,则下列说法中正确的是( )
| A. | 无色溶液中一定含有SO42- | |
| B. | 无色溶液中一定含有Ag+ | |
| C. | 无色溶液中一定同时含有SO42-和Ag+ | |
| D. | 无色溶液中可能含有Ag+和SO42-中的一种或两种 |
3.化学在生产、生活中有广泛应用,下列对应关系不正确的是( )
| 选项 | 性质 | 实际应用 |
| A | MgO熔点高 | 可用作耐火材料 |
| B | KMnO4具有强氧化性 | 可用于漂白织物 |
| C | 常温下,铁能被浓硫酸钝化 | 常温下,可用铁质器皿盛放浓硫酸 |
| D | TiCl4在水中能发生水解 | 可用TiCl4溶液制备TiO2 |
| A. | A | B. | B | C. | C | D. | D |
20.下列有关物质性质的叙述正确的是( )
| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | 次氯酸钠具有碱性,可用于配制“84”消毒液 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | SiO2既能溶于NaOH溶液又能溶于HF溶液,说明SiO2是两性氧化物 |
 )曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题:
)曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题: $→_{催化剂}^{CH_{3}CH=CH_{2}}$$\stackrel{A}{{C}_{9}{H}_{12}}$$→_{光照}^{Cl_{2}}$$\stackrel{B}{{C}_{9}{H}_{11}{C}_{1}}$→${\stackrel{C}{{C}_{9}{H}_{10}}}_{\;}$$\stackrel{HBr}{→}$$\stackrel{D}{{C}_{9}{H}_{11}Br}$→$\stackrel{E}{{C}_{9}{H}_{12}O}$$→_{△}^{催化剂}$龙葵醛
$→_{催化剂}^{CH_{3}CH=CH_{2}}$$\stackrel{A}{{C}_{9}{H}_{12}}$$→_{光照}^{Cl_{2}}$$\stackrel{B}{{C}_{9}{H}_{11}{C}_{1}}$→${\stackrel{C}{{C}_{9}{H}_{10}}}_{\;}$$\stackrel{HBr}{→}$$\stackrel{D}{{C}_{9}{H}_{11}Br}$→$\stackrel{E}{{C}_{9}{H}_{12}O}$$→_{△}^{催化剂}$龙葵醛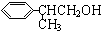 +O2
+O2
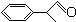 +2H2O.
+2H2O. 或
或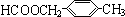 (任写一种).
(任写一种).