题目内容
7.氨及铵盐在中学化学及化工生产中占有重要地位.(1)合成氨是重要的工业反应:N2(g)+3H2(g)?2NH3(g),已知NH3与H2的燃烧热分别为:382.7KJ•mol-1、285.8KJ•mol-1,则合成氨反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.0KJ/mol.
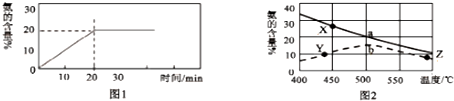
(2)在2L恒容装置中充入1molN2、3molI2,在500℃、催化剂的作用下发生反应,装置内NH3的体积百分含量如下图1所示,则下列有关叙述中正确的是:AC.
A.使用催化剂,可降低该反应的活化能,加快反应速率
B.容器内ν正(N2)=ν逆(H2)时,说明反应已达平衡
C.当容器内n(H 2):n(NH3)=3:1时,说明反应已达平衡
D.20分钟内ν(NH3)=0.033mol•L-1•min-1
(3)同时研究氨的含量与温度及催化剂的关系得到上图2,其中a线表示平衡时氨的含量,b线表示在使用催化剂下反应进行10分钟时氨的含量,比较X、Y两点的平衡常数大小并说明原因:Y点大,因为该反应正反应是放热反应,温度升高,k值减小,Y、Z两点的反应速率Y点大(填写“Y点大”或“Z点大”).
(4)已知:KSP[Mg(OH)2]=1.3×10-11,K(NH3•H2O)=1.8×10-5.
①Mg(OH)2+2NH4+?Mg2++2NH3•H2O的平衡常数K=0.040(保留两位有效数字).
②向0.01mol Mg(OH)2固体中加入1L 的0.03mol•L-1的NH4Cl溶液恰好使固体完全溶解.此时溶液中离子浓度由大到小的顺序为c(Cl-)>c(NH4+)=c(Mg2+)>c(OH-)>c(H+).
分析 (1)依据NH3与H2的燃烧热分别写出燃烧热的热化学方程式,再根据盖斯定律写目标反应的热化学方程式;
(2)N2(g)+3H2(g)?2NH3(g)
开始1mol 3mol 0
转化x 3x 2x
平衡1-x 3-3x 2x
则由图象可知平衡时NH3的含量为20%,所以有$\frac{2x}{1-x+3-3x+2x}$×100%=20%,解得x=$\frac{1}{3}$mol,
A.催化剂可降低该反应的活化能加快反应速率;
B.容器内同一种物质的正逆反应速率相等时,说明反应已达平衡;
C.根据以上计算分析计算;
D.根据v=$\frac{△c}{△t}$计算;
(3)根据平衡常数仅与温度有关,该反应正反应是放热反应,温度升高,平衡逆向移动判断;根据温度高催化剂失去活性,反应速率反而小判断;
(4)①根据Mg(OH)2+2NH4+?Mg2++2NH3•H2O的平衡常数K=$\frac{c(Mg{\;}^{2+})c(NH{\;}_{3}•H{\;}_{2}O){\;}^{2}}{c(NH{\;}_{4}{\;}^{+}){\;}^{2}}$=$\frac{c(Mg{\;}^{2+})c(OH{\;}^{-}){\;}^{2}}{K{\;}^{2}(NH{\;}_{3}•H{\;}_{2}O)}$=$\frac{K{\;}_{SP}[Mg(OH){\;}_{2}]}{K{\;}^{2}(NH{\;}_{3}•H{\;}_{2}O)}$计算;
②设加入1L的amol•L-1的NH4Cl溶液恰好使固体完全溶解,则根据反应方程式Mg(OH)2+2NH4+?Mg2++2NH3•H2O结合平衡常数K=0.04列方程计算,又生成氨水电离显碱性,所以此时溶液中离子浓度由大到小的顺序为c(Cl-)>c(NH4+)=c(Mg2+)>c(OH-)>c(H+).
解答 解:(1)表示H2燃烧热的化学方程式为:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
表示NH3燃烧热的化学方程式为:②NH3(g)+$\frac{3}{4}$O2(g)=$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l)△H=-382.7KJ/mol,
所以根据盖斯定律①×3-②×2得,N2(g)+3H2(g)?2NH3(g)△H=-285.8kJ/mol×3+382.7KJ/mol×2=-92.0KJ/mol
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.0KJ/mol;
(2)N2(g)+3H2(g)?2NH3(g)
开始1mol 3mol 0
转化x 3x 2x
平衡1-x 3-3x 2x
则由图象可知平衡时NH3的含量为20%,所以有$\frac{2x}{1-x+3-3x+2x}$×100%=20%,解得x=$\frac{1}{3}$mol,
A.催化剂可降低该反应的活化能加快反应速率,故A正确;
B.ν正(N2)=$\frac{1}{3}$ν正(H2),所以ν正(N2)=ν逆(H2)时,正逆反应速率不等,不能说明反应已达平衡,故B错误;
C.根据以上计算,平衡时n(H 2)=3-3×$\frac{1}{3}$=2mol,n(NH3)=2×$\frac{1}{3}$=$\frac{2}{3}$mol,则当容器内n(H 2):n(NH3)=3:1时,说明反应已达平衡,故C正确;
D.20分钟内ν(NH3)=$\frac{△c}{△t}$=$\frac{\frac{2×\frac{1}{3}mol}{2L}}{20min}$=0.0167mol•L-1•min-1,故D错误;
故选:AC;
(3)因为平衡常数仅与温度有关,又Y点温度比X高,该反应正反应又是放热反应,所以温度升高,平衡逆向移动,k值减小,则Y点k值大;又温度高催化剂失去活性,反应速率反而小,所以Y、Z两点的反应速率Y点大,故答案为:Y点大,因为该反应正反应是放热反应,温度升高,k值减小;Y点大;
(4)①由Mg(OH)2+2NH4+?Mg2++2NH3•H2O的平衡常数K=$\frac{c(Mg{\;}^{2+})c(NH{\;}_{3}•H{\;}_{2}O){\;}^{2}}{c(NH{\;}_{4}{\;}^{+}){\;}^{2}}$=$\frac{c(Mg{\;}^{2+})c(OH{\;}^{-}){\;}^{2}}{K{\;}^{2}(NH{\;}_{3}•H{\;}_{2}O)}$=$\frac{K{\;}_{SP}[Mg(OH){\;}_{2}]}{K{\;}^{2}(NH{\;}_{3}•H{\;}_{2}O)}$=$\frac{1.3×10{\;}^{-11}}{(1.8×10{\;}^{-5}){\;}^{2}}$=0.040,故答案为:0.040;
②设加入1L的amol•L-1的NH4Cl溶液恰好使固体完全溶解,则根据反应方程式
Mg(OH)2+2NH4+?Mg2++2NH3•H2O,
开始0.01mol a 0 0
转化0.01mol 0.02mol 0.01mol 0.02mol
平衡 0 a-0.02mol 0.01mol 0.02mol
又平衡常数K=$\frac{c(Mg{\;}^{2+})c(NH{\;}_{3}•H{\;}_{2}O){\;}^{2}}{c(NH{\;}_{4}{\;}^{+}){\;}^{2}}$=$\frac{0.01×0.02{\;}^{2}}{(a-0.02){\;}^{2}}$=0.04,解得a=0.03;
又生成氨水电离显碱性,所以此时溶液中离子浓度由大到小的顺序为c(Cl-)>c(NH4+)=c(Mg2+)>c(OH-)>c(H+)
故答案为:0.03; c(Cl-)>c(NH4+)=c(Mg2+)>c(OH-)>c(H+).
点评 本题考查了热化学方程式和盖斯定律计算应用、反应速率和化学平衡影响因素分析判断以及相关平衡常数的计算等,注意图象曲线变化的特征和化学平衡移动原理的理解应用,掌握基础是解题关键,题目难度中等.

| A. | C3N4 晶体是分子晶体 | |
| B. | C3N4 晶体中微粒间通过离子键结合 | |
| C. | C3N4 晶体中C-N键的键长比金刚石中C-C键的键长要长 | |
| D. | C3N4 晶体中每个C原子连接4个N 原子,而每个N原子连接3个C原子 |
| A. | 12g由${\;}_{6}^{12}$C60和${\;}_{6}^{14}$C60组成的固体中的原子数为NA | |
| B. | 4.4g由CO2和N2O组成的混合气体中的电子数为2.2NA | |
| C. | 常温常压下22.4LNH3中所含的共价键数为3NA | |
| D. | 1L1mol•L-1次氯酸溶液中的ClO-数为NA |
| A. | 1L 1mol/L的盐酸中含HCl分子的数目为NA | |
| B. | 1 mol Cl2与足量的铁反应转移的电子数是3 NA | |
| C. | 常温常压下,15g乙烷分子中含有的共价键键数目为3.5NA | |
| D. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA |
(1)上述反应的化学平衡常数表达式为K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随着温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)?W(s)+2H2O (g)△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O (g)△H=-137.9kJ?mol-1
则WO2(s)?WO2(g)的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2 (g) $?_{约3000℃}^{1400℃}$WI4 (g).下列说法正确的有a、b.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.

| A. | 200℃时,该反应的平衡常数为25 | |
| B. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| C. | 200℃时,原平衡中再加入0.4molC,则B的物质的量分数大于25% | |
| D. | 由图乙可知,反应xA(g)+yB(g)?zC(g)的△H<0,且△S<0 |
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+Cl2(g)?2ClNO(g)K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
(3)300℃时.2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k•cn(ClNO),
测得速率和浓度的关系如下表:
| 序号 | c(ClNO)/mol.L-1 | v/mol.L-1•s-1 |
| ① | 0.30 | 3.60×10${\;}^{-{9}^{\;}}$ |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
(4)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
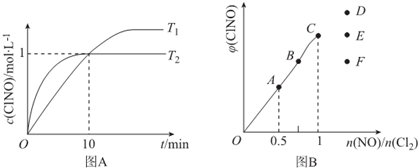
①该反应的△H<0(填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=0.1mol/(L•min),
③T2时该反应的平衡常数K=2
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{l}_{2})}$=的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点,当$\frac{n(NO)}{n(C{l}_{2})}$=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的D点.
| A. | 无色溶液中一定含有SO42- | |
| B. | 无色溶液中一定含有Ag+ | |
| C. | 无色溶液中一定同时含有SO42-和Ag+ | |
| D. | 无色溶液中可能含有Ag+和SO42-中的一种或两种 |
| A. | SiC是氧化产物 | |
| B. | 还原剂与氧化剂的物质的量之比为1:2 | |
| C. | 若生成4.48LCO,则转移0.4 mol 电子 | |
| D. | C 既是氧化剂又是还原剂 |