题目内容
4.PET是应用广泛的五大工程塑料之一,PET结构片段: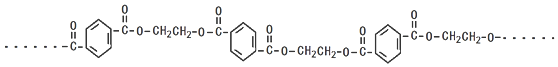
(1)①PET由两种有机物通过缩聚反应生成,其中分子较大的单体分子结构简式为
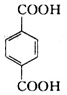 ,分子较小的单体含氧官能团名称是羟基.
,分子较小的单体含氧官能团名称是羟基.②PET塑料有多种降解途径,其中常用的甲醇法是在一定条件下将其与过量的甲醇作用,降解为两种小分子.该反应的化学方程式为:
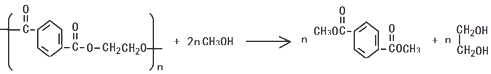 .
.(2)水杨酸(邻羟基苯甲酸)是合成阿司匹林(
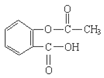 )的原料.
)的原料.①水杨酸与乙酸酐(
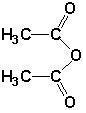 )反应生成阿司匹林的化学方程式:
)反应生成阿司匹林的化学方程式: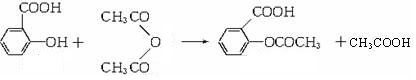 .
.②写出一种阿司匹林同分异构体的结构式
 ,该同分异构体符合以下条件:
,该同分异构体符合以下条件:a.芳香族化合物;
b.与氢氧化钠溶液共热,完全反应将消耗四倍物质的量的氢氧化钠;
c.苯环上氢原子被一个溴原子取代,可能的产物有两种.
分析 (1)①根据高分子化合物结构特点知,形成该高分子化合物需要的单体是 和HOCH2CH2OH,分子量较小的是乙二醇;
和HOCH2CH2OH,分子量较小的是乙二醇;
②PET塑料有多种降解途径,其中常用的甲醇法是在一定条件下将其与过量的甲醇作用,降解为两种小分子,两种小分子分别是对二苯甲酸二甲酯、乙二醇;
(2)①水杨酸和乙酸酐发生取代反应生成阿司匹林和乙酸;
②阿司匹林同分异构体符合下列条件:
a.芳香族化合物,说明含有苯环;
b.与氢氧化钠溶液共热,完全反应将消耗四倍物质的量的氢氧化钠,说明水解生成物中含有两个酚羟基、两个羧基;
c.苯环上氢原子被一个溴原子取代,可能的产物有两种,说明苯环上有两种氢原子.
解答 解:(1)①根据高分子化合物结构特点知,形成该高分子化合物需要的单体是 和HOCH2CH2OH,相对分子质量较大的是
和HOCH2CH2OH,相对分子质量较大的是 ,分子量较小的是乙二醇,乙二醇中官能团是羟基,
,分子量较小的是乙二醇,乙二醇中官能团是羟基,
故答案为: ;羟基;
;羟基;
②PET塑料有多种降解途径,其中常用的甲醇法是在一定条件下将其与过量的甲醇作用,降解为两种小分子,两种小分子分别是对二苯甲酸二甲酯、乙二醇,该反应方程式为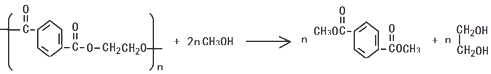 ,
,
故答案为: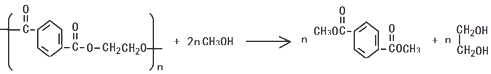 ;
;
(2)①水杨酸和乙酸酐发生取代反应生成阿司匹林和乙酸,反应方程式为 ,
,
故答案为: ;
;
②阿司匹林同分异构体符合下列条件:
a.芳香族化合物,说明含有苯环;
b.与氢氧化钠溶液共热,完全反应将消耗四倍物质的量的氢氧化钠,说明水解生成物中含有两个酚羟基、两个羧基;
c.苯环上氢原子被一个溴原子取代,可能的产物有两种,说明苯环上有两种氢原子,
则符合条件的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物合成,为高频考点,侧重考查学生分析判断能力,明确物质转化中断键和成键方式是解本题关键,难点是判断同分异构体结构简式确定,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=-2219.9KJ/mol
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO (g)+H2O(g)?CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是bd.
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
②T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如表:
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的.则第4~5min之间,改变的条件增加H2浓度,第5~6min之间,改变的条件是增加H2O(g)浓度.
已知420℃时,该化学反应的平衡常数为9.如果反应开始时,CO和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为75%.又知397℃时该反应的平衡常数为12,请判断该反应的△H<0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-.在电池内部O2-移向负极(填“正”或“负”);电池的负极反应式为C3H8+10O2--20e-=3CO2+4H2O.
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极的现象为有无色气体生成,有白色沉淀生成.
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=-2219.9KJ/mol
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO (g)+H2O(g)?CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是bd.
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
②T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如表:
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
已知420℃时,该化学反应的平衡常数为9.如果反应开始时,CO和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为75%.又知397℃时该反应的平衡常数为12,请判断该反应的△H<0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-.在电池内部O2-移向负极(填“正”或“负”);电池的负极反应式为C3H8+10O2--20e-=3CO2+4H2O.
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极的现象为有无色气体生成,有白色沉淀生成.
12.如表中实验“操作和现象”与“结论或目的一均正确的一组是( )
| 操作和现象 | 结论或目的 | |
| A | 向纯碱中滴加足量浓盐酸,将所得气体通入硅酸钠溶液中,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
| C | 取少量Fe(NO3)2试样加水溶液后加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | 目的:将不溶于酸的沉淀转化为易溶于酸的沉淀 |
| A. | A | B. | B | C. | C | D. | D |
19.对于相应化学用语的推论合理的是( )
| 选项 | 化学用语 | 推论 |
| A | ${\;}_{92}^{238}$U3+ | 该铀离子核外有89个电子 |
| B | 2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ•mol | 1mol氢气完全燃烧放出热量483.6kJ. |
| C | 2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ | NaCl氧化性比Cl2强 |
| D | FeO+4H++NO3-═Fe3++NO2↑+2H2O | 氧化亚铁溶于稀硝酸的离子方程式 |
| A. | A | B. | B | C. | C | D. | D |
9.设NA为阿伏伽德罗常数的数值.下列有关叙述正确的是( )
| A. | 12g由${\;}_{6}^{12}$C60和${\;}_{6}^{14}$C60组成的固体中的原子数为NA | |
| B. | 4.4g由CO2和N2O组成的混合气体中的电子数为2.2NA | |
| C. | 常温常压下22.4LNH3中所含的共价键数为3NA | |
| D. | 1L1mol•L-1次氯酸溶液中的ClO-数为NA |
2.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3(s)+3H2(g)$\stackrel{高温}{?}$W (s)+3H2O (g) 请回答下列问题:
(1)上述反应的化学平衡常数表达式为K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随着温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为1:1:4.
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)?W(s)+2H2O (g)△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O (g)△H=-137.9kJ?mol-1
则WO2(s)?WO2(g)的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2 (g) $?_{约3000℃}^{1400℃}$WI4 (g).下列说法正确的有a、b.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
(1)上述反应的化学平衡常数表达式为K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随着温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)?W(s)+2H2O (g)△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O (g)△H=-137.9kJ?mol-1
则WO2(s)?WO2(g)的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2 (g) $?_{约3000℃}^{1400℃}$WI4 (g).下列说法正确的有a、b.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
3.化学在生产、生活中有广泛应用,下列对应关系不正确的是( )
| 选项 | 性质 | 实际应用 |
| A | MgO熔点高 | 可用作耐火材料 |
| B | KMnO4具有强氧化性 | 可用于漂白织物 |
| C | 常温下,铁能被浓硫酸钝化 | 常温下,可用铁质器皿盛放浓硫酸 |
| D | TiCl4在水中能发生水解 | 可用TiCl4溶液制备TiO2 |
| A. | A | B. | B | C. | C | D. | D |
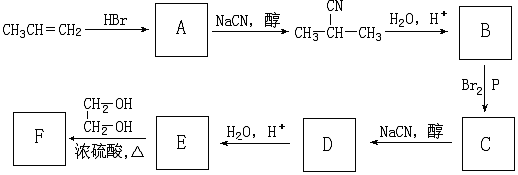
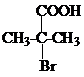 +NaCN$\stackrel{醇}{→}$NaBr+
+NaCN$\stackrel{醇}{→}$NaBr+ ,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$
,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$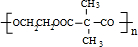 +2nH2O.
+2nH2O.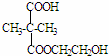 ,②分子内含有一个七元环
,②分子内含有一个七元环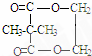 .
.