题目内容
3.NaNO2是一种食品添加剂,它与酸性KMnO4溶液发生反应 MnO4-+NO2-+X→Mn2++NO3-+H2O(未配平).下列叙述中正确的是( )| A. | 生成1 mol NaNO3需消耗0.4 mol KMnO4 | |
| B. | 反应过程中溶液的pH减小 | |
| C. | 该反应中NO${\;}_{2}^{-}$被还原 | |
| D. | X可以是盐酸 |
分析 该反应中锰元素化合价由+7价变为+2价,N元素化合价由+3价变为+5价,结合元素守恒、硝酸钠和高锰酸钾之间的关系式分析解答.
解答 解:该反应中Mn元素化合价由+7价变为+2价,所以MnO4-是氧化剂,NO2-应该作还原剂,亚硝酸根离子中N元素应该失电子化合价升高,酸性条件下,应该生成硝酸根离子,根据转移电子相等、原子守恒配平方程式为2MnO4-+5NO2-+6H+=2Mn2++5 NO3-+3H2O,
A.根据转移电子守恒得,生成1molNaNO3需消耗KMnO4的物质的量=$\frac{1mol×(5-3)}{(7-2)}$=0.4mol,故A正确;
B.根据元素守恒、电荷守恒知,X是H+,氢离子参加反应导致溶液中氢离子浓度降低,则溶液的pH增大,故B错误;
C.该反应中N元素化合价由+3价变为+5价,所以亚硝酸根离子失电子被氧化,故B错误;
D.根据BX是酸,但不可是还原性的盐酸,故D错误.
故选A.
点评 本题考查了氧化还原反应,为高频考点,注意根据反应中元素的化合价变化为解答的关键,注意转移电子守恒分析,X中的粒子需要电荷守恒,题目难度中等.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
14.丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=-2219.9KJ/mol
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO (g)+H2O(g)?CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是bd.
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
②T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如表:
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的.则第4~5min之间,改变的条件增加H2浓度,第5~6min之间,改变的条件是增加H2O(g)浓度.
已知420℃时,该化学反应的平衡常数为9.如果反应开始时,CO和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为75%.又知397℃时该反应的平衡常数为12,请判断该反应的△H<0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-.在电池内部O2-移向负极(填“正”或“负”);电池的负极反应式为C3H8+10O2--20e-=3CO2+4H2O.
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极的现象为有无色气体生成,有白色沉淀生成.
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=-2219.9KJ/mol
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO (g)+H2O(g)?CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是bd.
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
②T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如表:
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
已知420℃时,该化学反应的平衡常数为9.如果反应开始时,CO和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为75%.又知397℃时该反应的平衡常数为12,请判断该反应的△H<0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-.在电池内部O2-移向负极(填“正”或“负”);电池的负极反应式为C3H8+10O2--20e-=3CO2+4H2O.
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极的现象为有无色气体生成,有白色沉淀生成.
8.已知C3N4晶体具有比金刚石还大的硬度,且原子间均以单键结合.下列关于C3N4 晶体的说法正确的是( )
| A. | C3N4 晶体是分子晶体 | |
| B. | C3N4 晶体中微粒间通过离子键结合 | |
| C. | C3N4 晶体中C-N键的键长比金刚石中C-C键的键长要长 | |
| D. | C3N4 晶体中每个C原子连接4个N 原子,而每个N原子连接3个C原子 |
12.如表中实验“操作和现象”与“结论或目的一均正确的一组是( )
| 操作和现象 | 结论或目的 | |
| A | 向纯碱中滴加足量浓盐酸,将所得气体通入硅酸钠溶液中,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
| C | 取少量Fe(NO3)2试样加水溶液后加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | 目的:将不溶于酸的沉淀转化为易溶于酸的沉淀 |
| A. | A | B. | B | C. | C | D. | D |
2.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3(s)+3H2(g)$\stackrel{高温}{?}$W (s)+3H2O (g) 请回答下列问题:
(1)上述反应的化学平衡常数表达式为K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随着温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为1:1:4.
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)?W(s)+2H2O (g)△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O (g)△H=-137.9kJ?mol-1
则WO2(s)?WO2(g)的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2 (g) $?_{约3000℃}^{1400℃}$WI4 (g).下列说法正确的有a、b.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
(1)上述反应的化学平衡常数表达式为K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随着温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)?W(s)+2H2O (g)△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O (g)△H=-137.9kJ?mol-1
则WO2(s)?WO2(g)的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2 (g) $?_{约3000℃}^{1400℃}$WI4 (g).下列说法正确的有a、b.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.
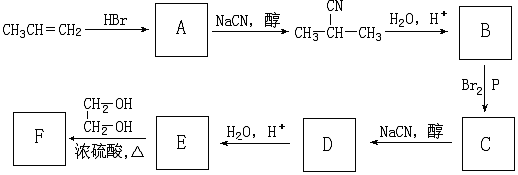
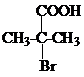 +NaCN$\stackrel{醇}{→}$NaBr+
+NaCN$\stackrel{醇}{→}$NaBr+ ,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$
,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$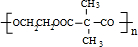 +2nH2O.
+2nH2O.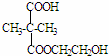 ,②分子内含有一个七元环
,②分子内含有一个七元环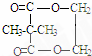 .
.