题目内容
14. 【化学-选修2化学与技术】
【化学-选修2化学与技术】许多含碳、氢物质是重要的化工原料.
(1)某新型储氢合金(化学式为Mg17Al12)的储氢原理为Mg17Al12+17H2═17MgH2+12Al,此变化中还原产物是MgH2(填化学式).
(2)草酸的钙盐、钡盐、镁盐难溶于水.已知C2O3是无色无味气体,可溶于水生成草酸(H2C2O4),写出它溶于足量Ba(OH)2溶液发生反应的化学方程式C2O3+Ba(OH)2=BaC2O4↓+H2O.
(3)已知:几个热化学方程式如下:
①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
| 化学键 | C≡O | O═O | C═O(CO2中) |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
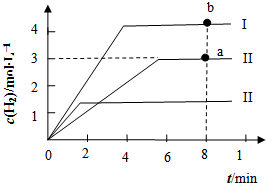
(4)向2L恒容密闭容器中充入3mol CH4(g)、4mol H2O(g),发生反应制备CO、H2,测得温度为t℃时,容器内H2的物质的量浓度(mol•L-1)随时间的变化如图中II曲线所示.图中I、III分别表示相对于II仅改变反应条件后,c(H2)随时间的变化.
①若曲线I仅代表改变一种条件后的情况,则改变的条件可能是升温;a、b两点用CO浓度变化表示的净反应速率关系为a<b;
②曲线II对应反应的平衡常数K为54.该温度下,若将等物质的量浓度的CH4(g)、H2O(g)、CO(g)、H2(g)混合充入该容器中,则开始进行方向是无法确定(填:向左、向右、平衡或无法确定).
③曲线III相对于曲线II改变的条件是B.
A.降低温度 B.使用催化剂、降低温度 C.加压.
分析 (1)氧化还原反应中元素化合价升高的被氧化得到氧化产物;
(2)C2O3是一种无色无味的气体,可溶于水生成草酸(H2C2O4),与足量Ba(OH)2溶液混合发生酸碱中和反应生成盐和水;
(3)依据图表键能计算反应焓变,CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2 ,结合热化学方程式和盖斯定律计算③-②-3×①得到所需热化学方程式;
(4)①若曲线Ⅰ代表的是仅变化一种条件后的情况,曲线Ⅰ达到平衡所需时间少,说明反应速率快,且生成氢气浓度大,平衡正向进行,改变条件是升温;
②曲线Ⅱ对应反应的平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,结合三行计算列式计算平衡浓度计算得到,若将等物质的量浓度的CH4、H2O、CO、H2混合在该容器中,计算此时浓度商和平衡常数比较判断反应进行的方向;
③曲线Ⅲ相对于曲线Ⅱ,达到平衡所需时间短,反应速率快,氢气浓度减小说明平衡逆向进行.
解答 解:(1)Mg17Al12+17H2=17MgH2+12Al,此变化中镁元素化合价0价变化为+2价,被氧化得到氧化产物是MgH2,故答案为:MgH2;
(2)C2O3是一种无色无味的气体,可溶于水生成草酸(H2C2O4),与足量Ba(OH)2溶液混合发生酸碱中和反应生成盐和水,反应的化学方程式为:C2O3+Ba(OH)2=BaC2O4↓+H2O,故答案为:C2O3+Ba(OH)2=BaC2O4↓+H2O;
(3)CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2 =(958.5+$\frac{1}{2}$×497-2×745)KJ/mol=-283KJ/mol,
①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-282.9KJ/mol,
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
依据盖斯定律计算③-②-3×①得到CH4(g)+H2O(g)?CO(g)+3H2(g)△H=30.7KJ/mol,
故答案为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=30.7KJ/mol;
(4)①若曲线Ⅰ代表的是仅变化一种条件后的情况,曲线Ⅰ达到平衡所需时间少,说明反应速率快,且生成氢气浓度大,平衡正向进行,改变条件是升温,a、b两点后,a点温度小于b点,所以用CO浓度变化表示的反应速率关系为a<b,
故答案为:升温;a<b;
②结合三行计算列式计算平衡浓度计算得到,图象中可知达到平衡状态氢气浓度为3mol/L,
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol/L) 1.5 2 0 0
变化量(mol/L) 1 1 1 3
平衡量(mol/L) 0.5 1 1 3
曲线Ⅱ对应反应的平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{3{\;}^{3}×1}{0.5×1}$=54,
若将等物质的量浓度的CH4、H2O、CO、H2混合在该容器中,设物质的量浓度为c,计算此时浓度商Qc=$\frac{c{\;}^{3}×c}{c×c}$=c2,和平衡常数无法比较大小,所以反应进行方向无法确定,开始时H2的生成速率和氢气消耗数量无法确定,
故答案为:54;无法确定;
③曲线Ⅲ相对于曲线Ⅱ,达到平衡所需时间短,反应速率快,氢气浓度减小说明平衡逆向进行,
A.降低温度反应速率减小,达到平衡时间增大,故A错误;
B.使用催化剂加快反应速率、降低温度平衡逆向进行,氢气浓度减小,故B正确;
C.充入氦气总压增大,气体分压不变平衡不变,故C错误;
故答案为:B.
点评 本题考查了氧化还原反应、热化学方程式和盖斯定律计算应用、焓变的计算、反应速率和化学平衡影响因素分析判断、注意图象曲线变化的特征和化学平衡移动原理的理解应用,掌握基础是解题关键,题目难度中等.

(1)上述反应的化学平衡常数表达式为K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随着温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)?W(s)+2H2O (g)△H=+66.0kJ?mol-1
WO2(g)+2H2(g)?W(s)+2H2O (g)△H=-137.9kJ?mol-1
则WO2(s)?WO2(g)的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2 (g) $?_{约3000℃}^{1400℃}$WI4 (g).下列说法正确的有a、b.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+Cl2(g)?2ClNO(g)K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
(3)300℃时.2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k•cn(ClNO),
测得速率和浓度的关系如下表:
| 序号 | c(ClNO)/mol.L-1 | v/mol.L-1•s-1 |
| ① | 0.30 | 3.60×10${\;}^{-{9}^{\;}}$ |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
(4)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
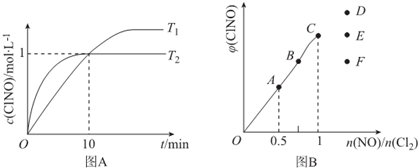
①该反应的△H<0(填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=0.1mol/(L•min),
③T2时该反应的平衡常数K=2
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{l}_{2})}$=的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点,当$\frac{n(NO)}{n(C{l}_{2})}$=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的D点.
| A. |  | B. |  | ||
| C. |  | D. |  |
| 选项 | 性质 | 实际应用 |
| A | MgO熔点高 | 可用作耐火材料 |
| B | KMnO4具有强氧化性 | 可用于漂白织物 |
| C | 常温下,铁能被浓硫酸钝化 | 常温下,可用铁质器皿盛放浓硫酸 |
| D | TiCl4在水中能发生水解 | 可用TiCl4溶液制备TiO2 |
| A. | A | B. | B | C. | C | D. | D |
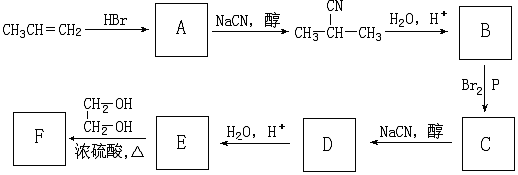
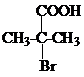 +NaCN$\stackrel{醇}{→}$NaBr+
+NaCN$\stackrel{醇}{→}$NaBr+ ,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$
,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$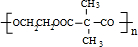 +2nH2O.
+2nH2O.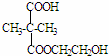 ,②分子内含有一个七元环
,②分子内含有一个七元环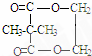 .
.