题目内容
钢铁生产中的尾气易造成环境污染,清洁生产工艺可消减污染源并充分利用.已知:
①Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g)△H=-25kJ/mol
②3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g)△H=-47kJ/mol
③Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)△H=+17kJ/mol
(1)试计算反应:FeO(s)+CO(g)?Fe(s)+CO2(g)的△H= .
(2)已知1092℃时(1)中反应的平衡常数为0.35,在1L的密闭容器中,投入7.2g FeO和0.1mol CO加热到1092℃并保持该温度,反应在t1时达平衡.
①t1时反应达平衡后,CO气体的体积分数为 .
②反应(1)在一定条件下达到平衡,则下列叙述表明该反应已经达到平衡状态的是 (填字母).
a.混合气体的密度不变 b.CO的浓度不再改变
c.v(CO)正=v(CO2)逆 d.容器内总压强不变
(3)含铁元素的高铁酸钾(K2FeO4)是一种优良的水处理剂.
①K2FeO4溶于水是一个可逆的过程,放出一种无色无味气体.其杀菌消毒、净化吸附水中的悬浮杂质的原理可用离子方程式表示为 .
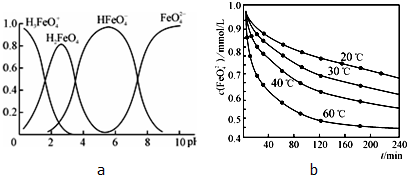
②FeO42-在水溶液中的存在形态如图a所示,纵坐标表示分数分布.则下列说法不正确的是 (填字母).
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为HFeO4-+OH-═FeO42-+H2O
③高铁酸钾还可制作充电电池,原理为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH
该电池充电时阳极电极反应式为 .
④将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0mmol/L的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图b.该操作的目的是 .
①Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g)△H=-25kJ/mol
②3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g)△H=-47kJ/mol
③Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)△H=+17kJ/mol
(1)试计算反应:FeO(s)+CO(g)?Fe(s)+CO2(g)的△H=
(2)已知1092℃时(1)中反应的平衡常数为0.35,在1L的密闭容器中,投入7.2g FeO和0.1mol CO加热到1092℃并保持该温度,反应在t1时达平衡.
①t1时反应达平衡后,CO气体的体积分数为
②反应(1)在一定条件下达到平衡,则下列叙述表明该反应已经达到平衡状态的是
a.混合气体的密度不变 b.CO的浓度不再改变
c.v(CO)正=v(CO2)逆 d.容器内总压强不变
(3)含铁元素的高铁酸钾(K2FeO4)是一种优良的水处理剂.
①K2FeO4溶于水是一个可逆的过程,放出一种无色无味气体.其杀菌消毒、净化吸附水中的悬浮杂质的原理可用离子方程式表示为
②FeO42-在水溶液中的存在形态如图a所示,纵坐标表示分数分布.则下列说法不正确的是
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为HFeO4-+OH-═FeO42-+H2O
③高铁酸钾还可制作充电电池,原理为:3Zn+2K2FeO4+8H2O
| 放电 |
| 充电 |
该电池充电时阳极电极反应式为
④将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0mmol/L的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图b.该操作的目的是

考点:用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理,化学平衡状态的判断,物质的量或浓度随时间的变化曲线
专题:基本概念与基本理论
分析:(1)依据热化学方程式和盖斯定律计算得到;
(2)①FeO(s)+CO(g)?Fe(s)+CO2(g)平衡常数为0.35,依据化学平衡三段式列式计算;
②反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断;
(3)①高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子能发生氧化还原反应生成氧气,同时生成氢氧化铁,氢氧化铁具有吸附性;
②根据图象的内容来分析图象所描述的意义;
③依据原电池反应,3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OHˉ;原电池的负极上锌失去电子发生氧化反应,正极上FeO42-+发生还原反应;电解池阳极解原电池正极;
④由图1数据可知,将试样分别置于不同温度的恒温水浴中,来测定c(FeO42-)的变化,显然是确定温度对FeO42-浓度的影响情况.
(2)①FeO(s)+CO(g)?Fe(s)+CO2(g)平衡常数为0.35,依据化学平衡三段式列式计算;
②反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断;
(3)①高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子能发生氧化还原反应生成氧气,同时生成氢氧化铁,氢氧化铁具有吸附性;
②根据图象的内容来分析图象所描述的意义;
③依据原电池反应,3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OHˉ;原电池的负极上锌失去电子发生氧化反应,正极上FeO42-+发生还原反应;电解池阳极解原电池正极;
④由图1数据可知,将试样分别置于不同温度的恒温水浴中,来测定c(FeO42-)的变化,显然是确定温度对FeO42-浓度的影响情况.
解答:
解:(1)①Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-25kJ/mol
②3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g)△H=-47kJ/mol
③Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)△H=+17kJ/mol
依据盖斯定律①×3-(③×2+②)得到:6FeO(s)+6CO(g)?6Fe(s)+6CO2(g)△H=-62kJ/mol;
得到FeO(s)+CO(g)?Fe(s)+CO2(g)△H=-10.3kJ/mol;
故答案为:-10.3 kJ/mol;
(2)①)①已知1092℃时(1)中反应的平衡常数为0.35,在1L的密闭容器中,投入7.2gFeO和0.1mol CO加热到1092℃并保持该温度,反应在t1时达平衡,依据化学平衡三段式列式计算设反应消耗的一氧化碳物质的量x:
FeO(s)+CO(g)?Fe(s)+CO2(g),
起始量(mol) 1 0
变化量(mol) x x
平衡量(mol) 1-x x
K=
=
=0.35
x=0.26
CO气体的体积分数=
×100%=74%;
故答案为:74%;
②a.混合气体的密度=
,质量变化,V不变,当密度不变,证明达到了平衡,故a正确;
b.CO的浓度不再改变是平衡的特征,故b正确;
c.v(CO)正=v(CO2)逆,说明正逆反应速率相等,达到了平衡,故c正确;
d.反应是前后体积不变的反应,当容器内总压强不变,不一定平衡,故d错误.
故选abc.
(3)①高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子和水反应生成氢氧化铁胶体,胶体具有吸附性是,所以能净水,反应方程式为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑,
故答案为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑;
②A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B.根据图片知,向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数先增大,后减小,故B错误;
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故C正确;
故答案为:AB;
③反应原理为:3Zn+2K2FeO4+8H2O?3Zn(OH)2+2Fe(OH)3+4KOH,原电池的负极发生氧化反应,正极电极反应式为:FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ;负极电极反应为:Zn-2e-+2OH-=Zn(OH)2;充电为电解池反应为,该电池充电时阳极连接原电池的正极:电极反应式为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O;
故答案为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O;
④由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,
故答案为:探究温度变化对FeO42-浓度的影响(或相同时间内不同温度下FeO42-浓度的大小变化).
②3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g)△H=-47kJ/mol
③Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)△H=+17kJ/mol
依据盖斯定律①×3-(③×2+②)得到:6FeO(s)+6CO(g)?6Fe(s)+6CO2(g)△H=-62kJ/mol;
得到FeO(s)+CO(g)?Fe(s)+CO2(g)△H=-10.3kJ/mol;
故答案为:-10.3 kJ/mol;
(2)①)①已知1092℃时(1)中反应的平衡常数为0.35,在1L的密闭容器中,投入7.2gFeO和0.1mol CO加热到1092℃并保持该温度,反应在t1时达平衡,依据化学平衡三段式列式计算设反应消耗的一氧化碳物质的量x:
FeO(s)+CO(g)?Fe(s)+CO2(g),
起始量(mol) 1 0
变化量(mol) x x
平衡量(mol) 1-x x
K=
| c(CO2) |
| c(CO) |
| x |
| 1-x |
x=0.26
CO气体的体积分数=
| 1-0.26 |
| 1 |
故答案为:74%;
②a.混合气体的密度=
| m |
| V |
b.CO的浓度不再改变是平衡的特征,故b正确;
c.v(CO)正=v(CO2)逆,说明正逆反应速率相等,达到了平衡,故c正确;
d.反应是前后体积不变的反应,当容器内总压强不变,不一定平衡,故d错误.
故选abc.
(3)①高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子和水反应生成氢氧化铁胶体,胶体具有吸附性是,所以能净水,反应方程式为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑,
故答案为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑;
②A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B.根据图片知,向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数先增大,后减小,故B错误;
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故C正确;
故答案为:AB;
③反应原理为:3Zn+2K2FeO4+8H2O?3Zn(OH)2+2Fe(OH)3+4KOH,原电池的负极发生氧化反应,正极电极反应式为:FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ;负极电极反应为:Zn-2e-+2OH-=Zn(OH)2;充电为电解池反应为,该电池充电时阳极连接原电池的正极:电极反应式为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O;
故答案为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O;
④由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,
故答案为:探究温度变化对FeO42-浓度的影响(或相同时间内不同温度下FeO42-浓度的大小变化).
点评:本题考查学生阅读题目获取信息的能力、氧化还原反应、电解原理的应用,原电池的工作原理的应用等.难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力,注意基础知识的全面掌握.

练习册系列答案
相关题目
下列物质属于非电解质的是( )
| A、HNO3 |
| B、Cl2 |
| C、NH4NO3 |
| D、SO2 |
用0.100mol?L-1的盐酸滴定10ml 0.100mol?L-1的Na2CO3溶液.溶液pH值与加入盐酸的体积的关系如图所示,已知室温时饱和CO2的pH为3.9,0.05mol?L-1 NaHCO3的pH约为8.3,下列说法不正确的是( )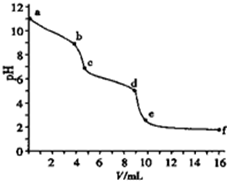

| A、以酚酞为指示剂,溶液颜色发生突变时(b点),Na2CO3转化为NaHCO3 |
| B、以甲基橙为指示剂,溶液颜色发生突变时,共消耗盐酸20.00ml |
| C、溶液pH=7(c点),碳酸钠完全转化为NaCl |
| D、ce段对应溶液中CO2与NaHCO3共存 |
下列叙述中不正确的是( )
| A、过氧化钠与水反应后的溶液滴加酚酞,液体会变为红色 |
| B、过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 |
| C、碳酸钠俗称大苏打,碳酸氢钠俗称苏打 |
| D、氧化铝是冶炼金属铝的重要原料,也是一种比较好的耐火材料,它可以用来制造耐火坩埚,耐火管和耐高温的实验仪器 |
 聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.
聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.