题目内容
 聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.
聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.(l)①PFS中对应价态铁离子的外围电子排布式是
②与SO42-属于等电子体的离子与分子有
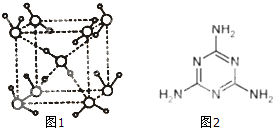
(2)水在不同的温度和压力条件下可以形成11种不同结构的晶体,密度从比水轻的0.92g/cm3扩到约为水的一倍半.冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物.其中冰一VII的晶体结构为一个如图1所示的立方晶胞,每个水分子可与周围
(3)毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺(结构如图2).
下列关于三聚氰胺分子的说法中正确的是
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
(4)根据等电子原理,写出NO2+离子结构式
考点:原子核外电子排布,判断简单分子或离子的构型,晶胞的计算
专题:化学键与晶体结构
分析:(1)①铁有两种阳离子,亚铁离子在空气中不能稳定存在,而铁离子在空气中科院稳定存在,可以推断化合价为+3价,铁离子的电子排布式为1s22s22p63s23p63d5;
②原子总数、电子总数相同的离子也是等电子体;
(2)看图一中间的水分子为对象数数与之相连的水分子个数和氢键数目;
(3)A.C=N中,C原子为sp2杂化,C=N中N原子为sp2杂化,-NH2中N原子为sp3杂化;
B.分子中含6个N-H,6个C-N,3个C=N;
C.分子结构对称,为非极性分子;
D.分子晶体,熔点较低;
(4)价电子数和原子数分别都相等的是等电子体,则与NO2+离子互为等电子体的是CO2,CO2是含有双键的直线形结构,所以根据等电子原理,NO2+和二氧化碳相似;与O22+离子互为等电子体的是氮气,氮气含有三键,而三键是由1个σ键和2个π键构成的,可推出O22+离子含π键数目.
②原子总数、电子总数相同的离子也是等电子体;
(2)看图一中间的水分子为对象数数与之相连的水分子个数和氢键数目;
(3)A.C=N中,C原子为sp2杂化,C=N中N原子为sp2杂化,-NH2中N原子为sp3杂化;
B.分子中含6个N-H,6个C-N,3个C=N;
C.分子结构对称,为非极性分子;
D.分子晶体,熔点较低;
(4)价电子数和原子数分别都相等的是等电子体,则与NO2+离子互为等电子体的是CO2,CO2是含有双键的直线形结构,所以根据等电子原理,NO2+和二氧化碳相似;与O22+离子互为等电子体的是氮气,氮气含有三键,而三键是由1个σ键和2个π键构成的,可推出O22+离子含π键数目.
解答:
解:(1)①絮状物在空气之中能稳定存在说明为铁离子,因为亚铁离子在空气中不稳定,故铁的化合价为+3价,铁离子的电子排布式为1s22s22p63s23p63d5,外围电子排布为3d5,故答案为3d5;
②SO42-、PO43-、ClO4-.三者原子数都是5,电子数都50,为等电子体,故答案为:PO43-、ClO4-;
(2)从图中可以看出,每个中心的水分子与上方面的2个对角的水分子形成氢键,与下方面的另外角的两个水分子形成氢键,共四个;
以中间的水分子为例,1mol水形成了2mol氢键,
故答案为:4;2;
(3)A.C=N中,C原子为sp2杂化,C=N中N原子为sp2杂化,-NH2中N原子为sp3杂化,杂化类型不同,故A错误;
B.分子中含6个N-H,6个C-N,3个C=N,双键中有1个σ键,共15个σ键,故B正确;
C.分子结构对称,为非极性分子,则不易溶于水,故C错误;
D.三聚氰胺为分子晶体,熔点较低,故D错误.
故选B;
(4)价电子数和原子数分别都相等的是等电子体,则与NO2+离子互为等电子体的是CO2.CO2是含有双键的直线形结构,则NO2+结构式为:[O=N=O]+;与O22+离子互为等电子体的是氮气.氮气含有三键,而三键是由1个σ键和2个π键构成的,则1 mol O22+中含有的π键数目为2NA,
故答案为:[O=N=O]+;2NA.
②SO42-、PO43-、ClO4-.三者原子数都是5,电子数都50,为等电子体,故答案为:PO43-、ClO4-;
(2)从图中可以看出,每个中心的水分子与上方面的2个对角的水分子形成氢键,与下方面的另外角的两个水分子形成氢键,共四个;
以中间的水分子为例,1mol水形成了2mol氢键,
故答案为:4;2;
(3)A.C=N中,C原子为sp2杂化,C=N中N原子为sp2杂化,-NH2中N原子为sp3杂化,杂化类型不同,故A错误;
B.分子中含6个N-H,6个C-N,3个C=N,双键中有1个σ键,共15个σ键,故B正确;
C.分子结构对称,为非极性分子,则不易溶于水,故C错误;
D.三聚氰胺为分子晶体,熔点较低,故D错误.
故选B;
(4)价电子数和原子数分别都相等的是等电子体,则与NO2+离子互为等电子体的是CO2.CO2是含有双键的直线形结构,则NO2+结构式为:[O=N=O]+;与O22+离子互为等电子体的是氮气.氮气含有三键,而三键是由1个σ键和2个π键构成的,则1 mol O22+中含有的π键数目为2NA,
故答案为:[O=N=O]+;2NA.
点评:本题考查了铁元素的核外电子排布和在空气中稳定存在化合价,看晶胞图判断分子个数和氢键个数等电子体等知识点,中等难度,注意等电子体的应用,外围电子和核外电子的区别.

练习册系列答案
相关题目
下列有关托盘天平的使用的叙述不正确的是( )
| A、称量前先调节托盘天平的零点 |
| B、潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 |
| C、用托盘天平只能称量至0.1g |
| D、称量时左盘放被称量物,右盘放砝码 |
下列说法正确的是( )
| A、1 molH2的质量是1 g |
| B、1 mol HCl的质量是36.5 g?mol-1 |
| C、Cl2的摩尔质量等于它的相对分子质量 |
| D、硫酸根离子的摩尔质量是96 g?mol-1 |
用特殊方法把固体物质加工到纳米级(1-100nm,1nm=10-9m即10-9m~10-7m)的超细粉末粒子,然后制得纳米材料.下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是( )
| A、胶体 | B、悬浊液 |
| C、溶液 | D、乳浊液 |
下列有关实验的叙述,正确的是( )
| A、用广泛pH试纸测得氯水的pH为2 |
| B、用托盘天平称取10.50g干燥的NaCl固体 |
| C、配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液的浓度偏高 |
| D、制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液时,胶头滴管不能伸入液面以下 |
 表示碳原子,用
表示碳原子,用 表示氧原子,用
表示氧原子,用 表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题: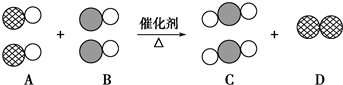
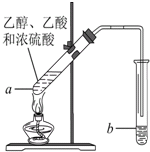 在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.