题目内容
下列叙述中不正确的是( )
| A、过氧化钠与水反应后的溶液滴加酚酞,液体会变为红色 |
| B、过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 |
| C、碳酸钠俗称大苏打,碳酸氢钠俗称苏打 |
| D、氧化铝是冶炼金属铝的重要原料,也是一种比较好的耐火材料,它可以用来制造耐火坩埚,耐火管和耐高温的实验仪器 |
考点:常见金属的活动性顺序及其应用
专题:元素及其化合物
分析:A.2Na2O2+2H2O=4NaOH+O2↑,无色酚酞遇碱液变红色;
B.2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑,氧气可以用于呼吸;
C.碳酸钠俗称是苏打,碳酸氢钠俗称是小苏打;
D.工业上用电解熔融氧化铝的方法冶炼铝,氧化铝熔点高,一般温度下不易熔融.
B.2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑,氧气可以用于呼吸;
C.碳酸钠俗称是苏打,碳酸氢钠俗称是小苏打;
D.工业上用电解熔融氧化铝的方法冶炼铝,氧化铝熔点高,一般温度下不易熔融.
解答:
解:A.2Na2O2+2H2O=4NaOH+O2↑,无色酚酞遇碱液变红色,NaOH是强碱,所以过氧化钠与水反应后的溶液滴加酚酞,液体会变为红色,故A正确;
B.人呼出的气体中含有二氧化碳和水蒸气,2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑,氧气可用于呼吸,所以过氧化钠可以用于呼吸面具或潜水艇中作为氧气的来源,故B正确;
C.碳酸钠俗称是苏打,碳酸氢钠俗称是小苏打,硫代硫酸钠俗称大苏打,故C错误;
D.工业上用电解熔融氧化铝的方法冶炼铝,氧化铝熔点高,一般温度下不易熔融,所以氧化铝是一种比较好的耐火材料,它可以用来制造耐火坩埚,耐火管和耐高温的实验仪器,故D正确;
故选C.
B.人呼出的气体中含有二氧化碳和水蒸气,2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑,氧气可用于呼吸,所以过氧化钠可以用于呼吸面具或潜水艇中作为氧气的来源,故B正确;
C.碳酸钠俗称是苏打,碳酸氢钠俗称是小苏打,硫代硫酸钠俗称大苏打,故C错误;
D.工业上用电解熔融氧化铝的方法冶炼铝,氧化铝熔点高,一般温度下不易熔融,所以氧化铝是一种比较好的耐火材料,它可以用来制造耐火坩埚,耐火管和耐高温的实验仪器,故D正确;
故选C.
点评:本题考查过氧化钠、铝的氧化物等知识点,明确物质性质是解本题关键,知道常见物质的俗称,会根据金属活泼性强弱确定冶炼方法,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、1 molH2的质量是1 g |
| B、1 mol HCl的质量是36.5 g?mol-1 |
| C、Cl2的摩尔质量等于它的相对分子质量 |
| D、硫酸根离子的摩尔质量是96 g?mol-1 |
向硫酸铝溶液中滴加下列试剂,有沉淀产生,且沉淀不会因加入试剂过量而消失的是( )
| A、NaOH |
| B、NH3?H2O |
| C、NaCl |
| D、MgCl2 |
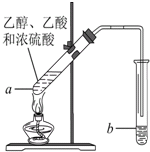 在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.