题目内容
在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a.各物质的浓度不变,b.平衡混合物中各组分的物质的量分数或质量分数不变,c.容器内气体压强不变,d.容器内气体密度不变,e.容器内气体颜色不变.
(1)能说明反应N2(g)+3H2(g)?2NH3(g)达到平衡状态的有 ;
(2)能说明反应H2(g)+I2(g)?2HI(g)达到平衡状态的有 ;
(3)能说明反应2NO2(g)?N2O4(g)达到平衡状态的有 .
(1)能说明反应N2(g)+3H2(g)?2NH3(g)达到平衡状态的有
(2)能说明反应H2(g)+I2(g)?2HI(g)达到平衡状态的有
(3)能说明反应2NO2(g)?N2O4(g)达到平衡状态的有
考点:化学平衡状态的判断
专题:化学平衡专题
分析:反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断.解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:(1)反应N2(g)+3H2(g)?2NH3(g),该反应是反应前后气体体积减小的反应,
a.各物质的浓度不变,说明正逆反应速率相等,达平衡状态,故正确;
b.平衡混合物中各组分的物质的量分数或质量分数不变,说明正逆反应速率相等,达平衡状态,故正确;
c.容器内气体压强不变,说明正逆反应速率相等,达平衡状态,故正确;
d.容器内气体密度不变,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
e.容器内气体颜色不变,整个体系没有颜色,颜色不能作为判断平衡的标志,故e错误;
故答案为:abc;
(2)反应H2(g)+I2(g)?2HI(g),
a.各物质的浓度不变,说明正逆反应速率相等,达平衡状态,故正确;
b.平衡混合物中各组分的物质的量分数或质量分数不变,说明正逆反应速率相等,达平衡状态,故正确;
c.两边气体计量数容器内气体压强始终不变,故错误;
d.容器内气体密度不变,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
e.容器内气体颜色不变,说明正逆反应速率相等,达平衡状态,故正确;
故答案为:abe;
(3)反应2NO2(g)?N2O4(g),
a.各物质的浓度不变,说明正逆反应速率相等,达平衡状态,故正确;
b.平衡混合物中各组分的物质的量分数或质量分数不变,说明正逆反应速率相等,达平衡状态,故正确;
c.容器内气体压强不变即物质的量不变,说明正逆反应速率相等,达平衡状态,故正确;
d.容器内气体密度不变,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
e.容器内气体颜色不变,说明二氧化氮的浓度不变,故正确;
故答案为:abce.
a.各物质的浓度不变,说明正逆反应速率相等,达平衡状态,故正确;
b.平衡混合物中各组分的物质的量分数或质量分数不变,说明正逆反应速率相等,达平衡状态,故正确;
c.容器内气体压强不变,说明正逆反应速率相等,达平衡状态,故正确;
d.容器内气体密度不变,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
e.容器内气体颜色不变,整个体系没有颜色,颜色不能作为判断平衡的标志,故e错误;
故答案为:abc;
(2)反应H2(g)+I2(g)?2HI(g),
a.各物质的浓度不变,说明正逆反应速率相等,达平衡状态,故正确;
b.平衡混合物中各组分的物质的量分数或质量分数不变,说明正逆反应速率相等,达平衡状态,故正确;
c.两边气体计量数容器内气体压强始终不变,故错误;
d.容器内气体密度不变,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
e.容器内气体颜色不变,说明正逆反应速率相等,达平衡状态,故正确;
故答案为:abe;
(3)反应2NO2(g)?N2O4(g),
a.各物质的浓度不变,说明正逆反应速率相等,达平衡状态,故正确;
b.平衡混合物中各组分的物质的量分数或质量分数不变,说明正逆反应速率相等,达平衡状态,故正确;
c.容器内气体压强不变即物质的量不变,说明正逆反应速率相等,达平衡状态,故正确;
d.容器内气体密度不变,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
e.容器内气体颜色不变,说明二氧化氮的浓度不变,故正确;
故答案为:abce.
点评:本题主要考查平衡平衡状态的判断,可以抓住本质特征:υ正=υ逆(同种物质),解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

练习册系列答案
相关题目
向xmL2.0mol/L的盐酸中投入ag镁铝合金,金属完全溶解,再加入ymL1.0mol/L的NaOH 溶液沉淀达到最大值,且质量为(a+1.7)g,则下列说法不正确的是( )
| A、a的取值范围为0.9g<a<1.2g |
| B、镁铝合金与盐酸反应时转移电子的数目为0.1NA |
| C、镁铝合金与盐酸反应产生H2的体积在常温常压下大于1.12L |
| D、x=2y |
将相等物质的量的CO和H2O(g)混合,在一定条件下反应:CO(g)+H2O(g)?CO2(g)+H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是( )
| A、46 | B、23 |
| C、11.5 | D、5.75 |
下列各组溶液,无论将少量前者滴入后者,还是将少量后者滴入前者,生成物一定相同的是( )
| A、NaOH溶液和AlCl3溶液 |
| B、FeBr2溶液和氯水 |
| C、NaHCO3溶液和澄清石灰水 |
| D、Ca(HCO3)2溶液和澄清石灰水 |
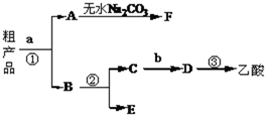 实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:
实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题: 绿矾是一种重要的化工原料.
绿矾是一种重要的化工原料.