题目内容
目前半导体的生产展开了一场“铜芯片”革命--在硅芯片上用铜丝代替铝布线,古老的金属铜在现代科技的应用上取得了新的突破,用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:
CuFeS2
Cu2S
Cu2O
Cu
(1)写出反应的化学方程式: 写出反应②的化学方程式: 假如上述各步都能完全反应,1000t含杂质8%的黄铜矿最多可得到含铜96%的粗铜质量为
(2)基态铜原子的价电子排布式为 .硫、氧元素相比,第一电离能较大的是 .
(3)在反应①、②中均有相同的气体分子生成,该分子的中心原子的杂化类型是 ;其立体结构是 .
(4)某学生用硫酸铜溶液与氨水做了一组实验:
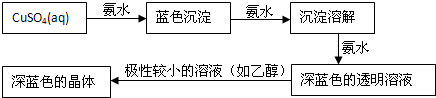
深蓝色溶液中的阳离子内存在的化学键类型有共价键和配位键.向此溶液中加入乙醇后可观察到析出深蓝色的晶体,该晶体的化学式为 .
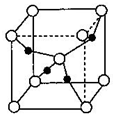
(5)氧化铜的晶胞结构如图所示,若该晶胞的边长为acm.则该氧化物的密度为 g?cm3(用NA表示阿伏加德罗常数的值)
CuFeS2
| O2 |
| 800℃ |
| O2 |
| △① |
| Cu2S |
| △② |
(1)写出反应的化学方程式:
(2)基态铜原子的价电子排布式为
(3)在反应①、②中均有相同的气体分子生成,该分子的中心原子的杂化类型是
(4)某学生用硫酸铜溶液与氨水做了一组实验:


深蓝色溶液中的阳离子内存在的化学键类型有共价键和配位键.向此溶液中加入乙醇后可观察到析出深蓝色的晶体,该晶体的化学式为
(5)氧化铜的晶胞结构如图所示,若该晶胞的边长为acm.则该氧化物的密度为
考点:晶胞的计算,原子核外电子排布,配合物的成键情况,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)由题给信息知反应①是Cu2S和O2反应生成Cu2O的反应,由于Cu元素的化合价不变,O元素的化合价降低,则S元素的化合价一定升高,结合所学知识知道生成的物质为二氧化硫.化学方程式为同理,反应②是Cu2O和Cu2S反应生成Cu的反应,Cu元素的化合价降低,元素S的化合价升高生成二氧化硫,知道了反应物和生成物,配平化学方程式即可;
(2)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写铜的基态原子价电子排布式;
同主族元素第一电离能自上而下逐渐减小;
(3)由(1)分析知反应①②生成的相同气体分子是SO2,SO2中价层电子对个数=2+
(6-2×2)=3,且含有一个孤电子对,所以其空间构型是V型,S原子采用sp2杂化;
(4)[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体[Cu(NH3)4]SO4;
(5)由均摊法计算氧化亚铜晶胞中Cu原子和O原子的数目,根据密度计算公式ρ=
计算即可.
(2)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写铜的基态原子价电子排布式;
同主族元素第一电离能自上而下逐渐减小;
(3)由(1)分析知反应①②生成的相同气体分子是SO2,SO2中价层电子对个数=2+
| 1 |
| 2 |
(4)[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体[Cu(NH3)4]SO4;
(5)由均摊法计算氧化亚铜晶胞中Cu原子和O原子的数目,根据密度计算公式ρ=
| m |
| V |
解答:
解:(1)由题给信息知反应①是Cu2S和O2反应生成Cu2O的反应,由于Cu元素的化合价不变,O元素的化合价降低,则S元素的化合价一定升高,结合所学知识知道生成的物质为二氧化硫.化学方程式为2Cu2S+3O2=2Cu2O+2SO2;
反应②是Cu2O和Cu2S反应生成Cu的反应,Cu元素的化合价降低,元素S的化合价升高生成二氧化硫,化学方程式为2Cu2O+Cu2S═6Cu+SO2;
由CuFeS2
Cu2S
Cu2O
Cu,根据Cu元素守恒,可得出1molCuFeS2生成1molCu,设制得粗铜质量为m,则
CuFeS2--Cu,
184t 64t
1000t×8% m×96%
64t×1000t×8%=184t×m×96%
解得m=29.0t;
故答案为:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S═6Cu+SO2;29.0t;
(2)Cu是29号元素,原子核外电子数为29,铜的基态原子价电子电子排布式3d104s1,同主族元素第一电离能自上而下逐渐减小,所以第一电离能较大的是氧;
故答案为:3d104s1;氧;
(3)由(1)分析知反应①②生成的相同气体分子是SO2,SO2中价层电子对个数=2+
(6-2×2)=3,所以S原子采用sp2杂化,由于含有一个孤电子对,其空间构型是V型;
故答案为:sp2;V型;
(4)向深蓝色透明溶液加入乙醇,由于[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体:Cu(NH3)4SO4?H2O;
故答案为:Cu(NH3)4SO4?H2O;
(5)O原子在晶胞的顶点和体心,故O原子数=8×
+1=2,Cu原子全部在体心,故Cu原子数=4,即一个氧化亚铜晶胞中有2个O原子和4个Cu原子,则该氧化物的密度ρ=
=
=
cm3.
故答案为:
.
反应②是Cu2O和Cu2S反应生成Cu的反应,Cu元素的化合价降低,元素S的化合价升高生成二氧化硫,化学方程式为2Cu2O+Cu2S═6Cu+SO2;
由CuFeS2
| O2 |
| 800℃ |
| O2 |
| △① |
| Cu2S |
| △② |
CuFeS2--Cu,
184t 64t
1000t×8% m×96%
64t×1000t×8%=184t×m×96%
解得m=29.0t;
故答案为:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S═6Cu+SO2;29.0t;
(2)Cu是29号元素,原子核外电子数为29,铜的基态原子价电子电子排布式3d104s1,同主族元素第一电离能自上而下逐渐减小,所以第一电离能较大的是氧;
故答案为:3d104s1;氧;
(3)由(1)分析知反应①②生成的相同气体分子是SO2,SO2中价层电子对个数=2+
| 1 |
| 2 |
故答案为:sp2;V型;
(4)向深蓝色透明溶液加入乙醇,由于[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体:Cu(NH3)4SO4?H2O;
故答案为:Cu(NH3)4SO4?H2O;
(5)O原子在晶胞的顶点和体心,故O原子数=8×
| 1 |
| 8 |
| m |
| V |
| ||
| a3 |
| 320 |
| a3?NA |
故答案为:
| 320 |
| a3?NA |
点评:本田考查了晶胞的计算、核外电子排布、杂化轨道方式以及分子构型和配合物的内容,综合性较强,难度中等,利用均摊法计算晶胞的组成.

练习册系列答案
相关题目
某双原子分子构成的气体,其摩尔质量为M g/mol,该气体质量为m g,阿伏加德罗常数为NA,则:
(1)该气体的物质的量为 mol.
(2)该气体所含原子总数为 个.
(3)该气体的一个分子的质量为 g.
(1)该气体的物质的量为
(2)该气体所含原子总数为
(3)该气体的一个分子的质量为
水的电离平衡曲线如图所示,下列说法不正确的是( )
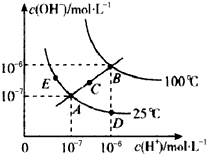

| A、从图中可以看出,水的电离是吸热过程 |
| B、若从A点到D点,可采用:温度不变在水中加入适量的NH4Cl固体 |
| C、在处于C点状态的溶液中:Na+、Al3+、CO32-、Cl-能够大量共存 |
| D、在处于E点状态的CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH+)>c(H+) |
用特殊方法把固体物质加工到纳米级(1-100nm,1nm=10-9m即10-9m~10-7m)的超细粉末粒子,然后制得纳米材料.下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是( )
| A、胶体 | B、悬浊液 |
| C、溶液 | D、乳浊液 |
向硫酸铝溶液中滴加下列试剂,有沉淀产生,且沉淀不会因加入试剂过量而消失的是( )
| A、NaOH |
| B、NH3?H2O |
| C、NaCl |
| D、MgCl2 |
 实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:
实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题: