题目内容
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂等.工业上可利用煤的气化产物(水煤气)合成二甲醚.
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H= .
(2)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为64.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”).
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)
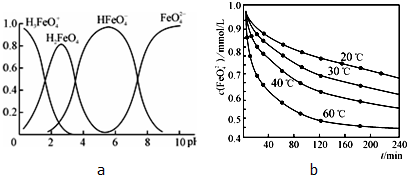
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[
]的变化曲线如图1:
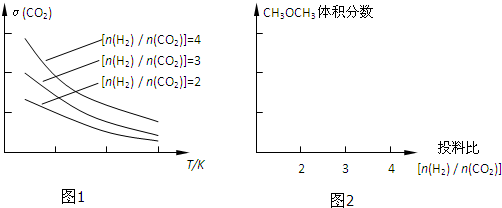
若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”);在其他条件不变时,请在图2中画出平衡时CH3OCH3的体积分数随投料比[
]变化的曲线图.
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=
(2)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为64.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 1.44 | 9.6 | 9.6 |
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)
| 催化剂 |
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[
| n(H2) |
| n(CO2) |

若温度升高,则反应的平衡常数K将
| n(H2) |
| n(CO2) |
考点:用盖斯定律进行有关反应热的计算,化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:(1)利用盖斯定律计算化学反应的焓变即可;
(2)计算浓度商和平衡常数比较判断,确定反应的移动方向进而确定正逆反应速率的大小;
(3)根据化学方程式的系数进行回答;根据温度和压强对化学平衡常数的影响:放热反应:升高温度,K减小,反之K增大;吸热反应:升高温度,K增大,反之K减小.
(2)计算浓度商和平衡常数比较判断,确定反应的移动方向进而确定正逆反应速率的大小;
(3)根据化学方程式的系数进行回答;根据温度和压强对化学平衡常数的影响:放热反应:升高温度,K减小,反之K增大;吸热反应:升高温度,K增大,反之K减小.
解答:
解:(1)①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则△H=-90.8kJ?mol-1×2-23.5kJ?mol-1-41.3kJ?mol-1=-246.4kJ?mol-1;
故答案为:-246.4kJ?mol-1;
(2)Q=
=
=44.4<64,平衡正向进行,v(正)>v(逆),故答案为:>;
(3)CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]的增大而增大,根据反应知道当体积比是3的时候,甲醚的体积分数最大,如下图所示:
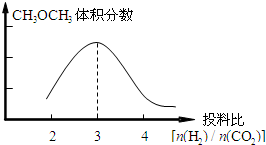 ,根据图一可以看出,对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,所以温度升高,K减小,故答案为:
,根据图一可以看出,对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,所以温度升高,K减小,故答案为: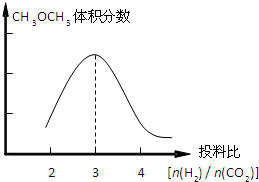 ;减小.
;减小.
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则△H=-90.8kJ?mol-1×2-23.5kJ?mol-1-41.3kJ?mol-1=-246.4kJ?mol-1;
故答案为:-246.4kJ?mol-1;
(2)Q=
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| 9.6×9.6 |
| 1.442 |
(3)CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]的增大而增大,根据反应知道当体积比是3的时候,甲醚的体积分数最大,如下图所示:
 ,根据图一可以看出,对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,所以温度升高,K减小,故答案为:
,根据图一可以看出,对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,所以温度升高,K减小,故答案为: ;减小.
;减小.
点评:本题考查了盖斯定律的计算应用、平衡常数的计算应用,注意平衡常数随温度变化,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、摩尔是物质的数量单位 |
| B、58.5gNaCl溶解在1L水中,得到溶液的物质的量浓度为1mol/L |
| C、标况下,1molCCl4所占的体积约为22.4L |
| D、12g12C含有的碳原子数约为6.02×1023个 |
下列有关实验的叙述,正确的是( )
| A、用广泛pH试纸测得氯水的pH为2 |
| B、用托盘天平称取10.50g干燥的NaCl固体 |
| C、配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液的浓度偏高 |
| D、制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液时,胶头滴管不能伸入液面以下 |
向xmL2.0mol/L的盐酸中投入ag镁铝合金,金属完全溶解,再加入ymL1.0mol/L的NaOH 溶液沉淀达到最大值,且质量为(a+1.7)g,则下列说法不正确的是( )
| A、a的取值范围为0.9g<a<1.2g |
| B、镁铝合金与盐酸反应时转移电子的数目为0.1NA |
| C、镁铝合金与盐酸反应产生H2的体积在常温常压下大于1.12L |
| D、x=2y |
 表示碳原子,用
表示碳原子,用 表示氧原子,用
表示氧原子,用 表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题: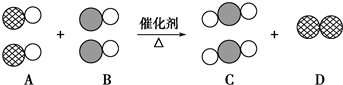
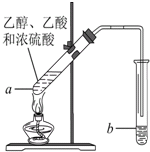 在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.