题目内容
20.下列说法正确的是( )| A. | 化合反应一定是氧化还原反应 | B. | 非金属氧化物一定是酸性氧化物 | ||
| C. | 金属氧化物一定是碱性氧化物 | D. | 碱性氧化物一定是金属氧化物 |
分析 A、有的化合反应中不存在元素化合价的变化,有的存在;
B、酸性氧化物是指能和碱反应生成盐和水的氧化物;
C、碱性氧化物是指能和酸反应生成盐和水的氧化物;
D、大多数的金属氧化物属于碱性氧化物.
解答 解:A、有的化合反应中不存在元素化合价的变化,有的存在,化合反应不一定是氧化还原反应,如氧化钠和水生成氢氧化钠的反应,故A错误;
B、非金属氧化物不一定是酸性氧化物,如NO、CO等不属于酸性氧化物,故B错误;
C、金属氧化物一定是碱性氧化物,如氧化铝属于两性氧化物,故C错误;
D、大多数的金属氧化物属于碱性氧化物,碱性氧化物是指能和酸反应生成盐和水的氧化物,碱性氧化物一定是金属氧化物,故D正确.
故选D.
点评 本题涉及物质的分类、化学反应之间的关系知识,明确酸性氧化物、碱性氧化物的概念和内涵是解题的关键,难度中等.

练习册系列答案
相关题目
11.过渡元素在生活、生产和科技等方面有广泛的用途.
(1)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+有(填“有”或“无”)颜色.
(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.下列说法中不正确的是D.(填序号)
A.PFS中铁显+3价
B.铁原子的外围电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用.现有铬(Ⅲ)与甲基丙烯酸根的配合物为:{Cr2[OOC-C(CH3)═CH2]2(H2O)8}Cl4
①该化合物中存在的化学键类型有配位键、共价键、离子键.
②甲基丙烯酸分子中C原子的杂化方式有sp3和sp2.
③等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是H2S(填一种即可).
④与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是K、Cu(填元素符号).
(1)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+有(填“有”或“无”)颜色.
(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.下列说法中不正确的是D.(填序号)
A.PFS中铁显+3价
B.铁原子的外围电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| 元素 | Mn | Fe | |
| 电离能 | I1 | 717 | 759 |
| (kJ•mol-1) | I2 | 1 509 | 1 561 |
| I3 | 3 248 | 2 957 | |
①该化合物中存在的化学键类型有配位键、共价键、离子键.
②甲基丙烯酸分子中C原子的杂化方式有sp3和sp2.
③等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是H2S(填一种即可).
④与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是K、Cu(填元素符号).
15.下列有关化工生产的叙述正确的是( )
| A. | 合成氨生产过程中将NH3液化分离,减小氨气的浓度会导致化学平衡向左移动 | |
| B. | 合成氨工业中,使用铁催化剂可加快正反应速率,提高N2、H2的转化率 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 | |
| D. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |

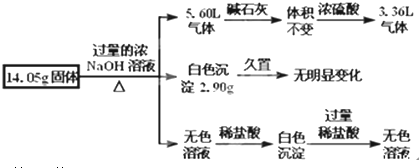
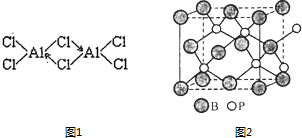 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: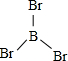 三溴化磷
三溴化磷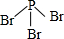
 +2NaOH $\stackrel{△}{→}$
+2NaOH $\stackrel{△}{→}$  +H2O.
+H2O. 是一种重要的有机合成中间体.
是一种重要的有机合成中间体. ;②光照时,甲苯与Cl2侧链取代.
;②光照时,甲苯与Cl2侧链取代.