题目内容
10.铁在自然界分布广泛,在工业、农业和国防科技中有重要应用.(1)工业上用铁矿石(赤铁矿)冶炼生铁的主要反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)钢铁“发蓝”是在钢铁表面形成一层致密的Fe3O4薄膜的技术.其中一种办法是将钢铁制品浸到NaNO2和浓NaOH的混合溶液中加热到130℃.其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH═3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+5H2O═3Na2Fe2O4+NH3↑+7NaOH
③Na2FeO2+Na2Fe2O4+2H2O═Fe3O4+4NaOH
则反应②中的氧化剂是NaNO2(填化学式),整个过程中,每有84gFe参加反应,则转移4mol电子.
(3)某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰.你认为Fe(NO3)3溶液蚀刻银的原因可能是Fe(NO3)3溶液显酸性,在此酸性条件下硝酸根离子能氧化Ag.
(4)烧杯中盛有100mL FeCl3、FeCl2、CuCl2的混合液,其中各物质的物质的量浓度均为1mol/L,向该混合液中加入一定量的铁粉,若反应完毕时,烧杯中无固体物质剩余,则此时溶液中一定含有的金属离子是Fe2+、Cu2+,设它们的物质的量之和为a mol,则a的取值范围是0.2<a≤0.35.
分析 (1)CO还原氧化铁生成Fe、二氧化碳;
(2)反应②6Na2FeO2+NaNO2+5H2O═3Na2Fe2O4+NH3↑+7NaOH中,Fe元素化合价由+2价变为+3价、N元素化合价由+3价变为-3价,得电子的物质是氧化剂,失电子的物质是还原剂,还原剂被氧化;整个过程中,铁由0价变+$\frac{8}{3}$价,所以1mol的铁转移$\frac{8}{3}$mol的电子;
(3)Fe(NO3)3溶液蚀刻银,发生氧化还原反应;
(4)加入一定量的铁粉,若反应完毕时,烧杯中无固体物质剩余,可能只与铁离子反应,可能恰好与铁离子完全反应,以此计算.
解答 解:(1)工业上用铁矿石(赤铁矿)冶炼生铁的主要反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)反应②6Na2FeO2+NaNO2+5H2O═3Na2Fe2O4+NH3↑+7NaOH中,Fe元素化合价由+2价变为+3价、N元素化合价由+3价变为-3价,得电子的物质是氧化剂,失电子的物质是还原剂,还原剂被氧化,可知NaNO2为氧化剂;整个过程中,铁由0价变+$\frac{8}{3}$价,所以1mol的铁转移$\frac{8}{3}$mol的电子,则每有84gFe参加反应,则转移电子为$\frac{84g}{56g/mol}$×$\frac{8}{3}$=4mol,故答案为:NaNO2;4;
(3)Fe(NO3)3溶液蚀刻银的原因可能是Fe(NO3)3溶液显酸性,在此酸性条件下硝酸根离子能氧化Ag,故答案为:Fe(NO3)3溶液显酸性,在此酸性条件下硝酸根离子能氧化Ag;
(4)加入一定量的铁粉,若反应完毕时,烧杯中无固体物质剩余,可能只与铁离子反应,可能恰好与铁离子完全反应,只发生2FeCl3+Fe=3FeCl2,溶液中阳离子一定含Fe2+、Cu2+,100mL FeCl3、FeCl2、CuCl2的混合液,其中各物质的物质的量浓度均为1mol/L,物质的量均为0.1mol,未反应前Fe2+、Cu2+之和为0.2mol,发生2FeCl3+Fe=3FeCl2后Fe2+、Cu2+之后为0.35mol,则0.2<a≤0.35,
故答案为:Fe2+、Cu2+;0.2<a≤0.35.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中化合价变化、发生的反应为解答的关键,侧重分析与计算能力的考查,综合性较强,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 化合反应一定是氧化还原反应 | B. | 非金属氧化物一定是酸性氧化物 | ||
| C. | 金属氧化物一定是碱性氧化物 | D. | 碱性氧化物一定是金属氧化物 |
| A. | 放电时,Mo3S4发生氧化反应 | |
| B. | 放电时,负极反应式:Mo3S4+2xe-→Mo3S42x- | |
| C. | 充电时,Mg2+向阴极迁移 | |
| D. | 充电时,阳极反应式:xMg2++2xe-→xMg |
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将蘸有浓硫酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 | 无明显现象 | 氨气与硫酸不反应 |
| B | 用干净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃片可以看到紫色的火焰 | 该溶液中有钾离子 |
| C | 在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中 | 产生苍白色火焰 | 物质燃烧不一定需要氧气 |
| D | 加热试管中的氯化铵固体 | 试管底部的固体逐渐消失 | 氯化铵受热分解 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 原电池阳极发生氧化反应 | |
| C. | 电解池阴极发生还原反应 | |
| D. | 电解池的阴极连接电源正极 |
| A. | Al3+与SO42-的物质的量浓度之比为2:3 | |
| B. | 1L溶液中SO42-的物质的量为1.5mol | |
| C. | 准确称取17.1g的Al2(SO4)3用100 mL蒸馏水溶解可配制得到该浓度的溶液 | |
| D. | 从1L 0.5 mol•L-1Al2(SO4)3溶液中取出100mL,Al3+浓度仍为1 mol•L-1 |
| A. | MOH能被醋酸中和 | |
| B. | 用MOH溶液做导电性实验,灯泡亮度较暗 | |
| C. | MOH可使酚酞试液变红 | |
| D. | 常温时0.1mol•L-1MOH溶液的pH约为11 |
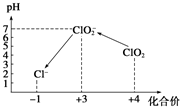 Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.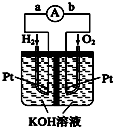 在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等.
在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等.