题目内容
含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示,下列表述正确的( )


| A、pH=6时,C(H+)=C(SO32-)+C(OH-) |
| B、pH=2时,溶液中存在:C(Na+)>C(HSO3-)>C(H2SO3)>C(SO32-) |
| C、向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中会出现浑浊且pH值降为2,其离子方程式可表示为:Ca2++SO32-═CaSO3 |
| D、由图可知亚硫酸氢钠溶液呈酸性 |
考点:离子浓度大小的比较
专题:
分析:A.由图可知,pH=6时,为亚硫酸钠和亚硫酸氢钠的混合物,根据电荷守恒:C(H+)+C(Na+)=2C(SO32-)+C(HSO3-)+C(OH-),由物料守恒可知:C(Na+)>C(SO32-)+(HSO3-),联立判断;
B.由图可知,pH=2时,C(HSO3-)=C(H2SO3);
C.亚硫酸钙难溶于水,亚硫酸氢根离子属于弱电解质,应该写化学式;
D.根据图象知,pH在3.5~5.5之间为亚硫酸氢钠.
B.由图可知,pH=2时,C(HSO3-)=C(H2SO3);
C.亚硫酸钙难溶于水,亚硫酸氢根离子属于弱电解质,应该写化学式;
D.根据图象知,pH在3.5~5.5之间为亚硫酸氢钠.
解答:
解:A.由图可知,pH=6时,为亚硫酸钠和亚硫酸氢钠的混合物,根据电荷守恒:C(H+)+C(Na+)=2C(SO32-)+C(HSO3-)+C(OH-),由物料守恒可知:C(Na+)>C(SO32-)+(HSO3-),联立可得:C(H+)>C(SO32-)+C(OH-),故A错误;
B.由图可知,pH=2时,C(HSO3-)=C(H2SO3),故B错误;
C.亚硫酸钙难溶于水,亚硫酸氢根离子属于弱电解质,离子反应为HSO3-+Ca2+=CaSO3↓+H+,故C错误;
D.根据图象知,pH在3.5~5.5之间为亚硫酸氢钠,故亚硫酸氢钠溶液呈酸性,故D正确,
故选D.
B.由图可知,pH=2时,C(HSO3-)=C(H2SO3),故B错误;
C.亚硫酸钙难溶于水,亚硫酸氢根离子属于弱电解质,离子反应为HSO3-+Ca2+=CaSO3↓+H+,故C错误;
D.根据图象知,pH在3.5~5.5之间为亚硫酸氢钠,故亚硫酸氢钠溶液呈酸性,故D正确,
故选D.
点评:本题考查离子浓度大小比较,明确图中纵横坐标含义及溶液中溶质是解本题关键,易错选项是C,亚硫酸氢根离子应该写化学式,且亚硫酸氢根离子电离程度大于水解程度,题目难度中等.

练习册系列答案
相关题目
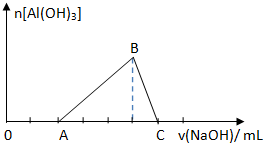 已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液体积的关系如图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )
已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液体积的关系如图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )| A、原混合溶液中c(Fe3+):c(Al3+)=1:1 |
| B、B点两种沉淀共存,此时上层清液中c(Fe3+)=c(Al3+)=0 |
| C、B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104:1 |
| D、C点溶液中的溶质只有NaAlO2 |
pH=3的盐酸a L分别与下列三种溶液混合后,溶液均呈中性:其中a、b、c、d的关系正确的是( )
①1×10-3 mol?L-1的氨水b L
②1×10-3 mol?L-1的氨水c L
③1×10-3 mol?L-1的Ba(OH)2溶液d L.
①1×10-3 mol?L-1的氨水b L
②1×10-3 mol?L-1的氨水c L
③1×10-3 mol?L-1的Ba(OH)2溶液d L.
| A、b>a>d>c |
| B、b>a=d>c |
| C、a=b>c>d |
| D、c>a=d>b |
25℃时,几种弱酸的电离常数如下:25℃时,下列说法正确的是( )
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B、a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b |
| C、NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| D、某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
化学与生活密切相关,下列说法不正确的是( )
| A、水果、蔬菜多属于酸性食物 |
| B、煤中加入适量石灰石可减少SO2的排放 |
| C、青霉素是最重要的抗生素,具有消炎的作用 |
| D、误食重金属盐中毒,可通过喝大量牛奶缓解毒性 |


 卤族元素的单质和化合物很多,一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物.请利用所学物质结构与性质的相关知识回答下列问题:
卤族元素的单质和化合物很多,一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物.请利用所学物质结构与性质的相关知识回答下列问题: 和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6