题目内容
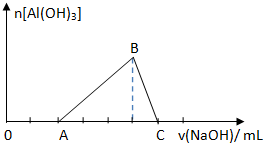 已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液体积的关系如图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )
已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液体积的关系如图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )| A、原混合溶液中c(Fe3+):c(Al3+)=1:1 |
| B、B点两种沉淀共存,此时上层清液中c(Fe3+)=c(Al3+)=0 |
| C、B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104:1 |
| D、C点溶液中的溶质只有NaAlO2 |
考点:有关混合物反应的计算
专题:
分析:因为Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38,所以向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,首先铁离子先沉淀,铁离子全部沉淀后,铝离子开始沉淀,再滴加氢氧化钠氢氧化铝溶解,则OA段发生反应:Fe3++3OH-═Fe(OH)3↓,AB段发生反应:Al3++3OH-═Al(OH)3↓,BC段发生反应:Al(OH)3+OH-═AlO2-+2H2O,据此结合图象分析解答.
解答:
解:A.根据题意可知,OA段发生反应:Fe3++3OH-═Fe(OH)3↓,AB段发生反应:Al3++3OH-═Al(OH)3↓,两阶段消耗NaOH溶液的体积比为2:3,所以原混合溶液中c(Fe3+):c(Al3+)=2:3,故A错误;
B.B点沉淀达最大值,为Fe(OH)3、Al(OH)3两种沉淀,存在溶解平衡,溶液中c(Fe3+)、c(Al3+)不为0,故B错误;
C.B点沉淀达最大值,为Fe(OH)3、Al(OH)3两种沉淀,当两种沉淀共存时,由于Ksp[Al(OH)3]=c(Al3+)?c3(OH-),Ksp[Fe(OH)3]=c(Fe3+)?c3(OH-),所以c(Al3+):c(Fe3+)=Ksp[Al(OH)3]:Ksp[Fe(OH)3]=2.5×104,故C正确;
D.C点时溶液中的溶质主要有NaAlO2、NaNO3等,故D错误;
故选C.
B.B点沉淀达最大值,为Fe(OH)3、Al(OH)3两种沉淀,存在溶解平衡,溶液中c(Fe3+)、c(Al3+)不为0,故B错误;
C.B点沉淀达最大值,为Fe(OH)3、Al(OH)3两种沉淀,当两种沉淀共存时,由于Ksp[Al(OH)3]=c(Al3+)?c3(OH-),Ksp[Fe(OH)3]=c(Fe3+)?c3(OH-),所以c(Al3+):c(Fe3+)=Ksp[Al(OH)3]:Ksp[Fe(OH)3]=2.5×104,故C正确;
D.C点时溶液中的溶质主要有NaAlO2、NaNO3等,故D错误;
故选C.
点评:本题考查溶度积有关计算、混合物计算等,明确各阶段发生的反应是关键,题目综合性较大,难度较大.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种.若将纳米碳均匀地分散到蒸馏水中,所形成的物质 ①是溶液 ②是胶体 ③是浊液 ④不能透过滤纸 ⑤能透过滤纸 ⑥能产生丁达尔效应 ⑦静置后,会析出黑色沉淀( )
| A、②⑤⑥ | B、②⑥⑦ |
| C、①⑤ | D、③④⑦ |
一定温度下,将4mol HCl 和1 mol O2 充入一恒容密闭容器中发生可逆反应4HCl(g)+O2(g)?2Cl2(g)+2H2O(g),下面示意图正确且说明反应达到平衡状态的是( )
A、 |
B、 |
C、 |
D、 |
可逆反应:2NO2
2NO+O2在密闭容器反应,达到平衡状态的标志是( )
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时,生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
| △ |
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时,生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
| A、(1)(3)(4) |
| B、(2)(3)(5) |
| C、(1)(4)(5) |
| D、(1)(2)(3)(4)(5) |
下列说法正确的是( )
| A、当酸碱恰好完全中和时,溶液呈中性 |
| B、若溶液中c(H+)与c(OH-)相等,溶液肯定呈中性 |
| C、0.005 mol?L-1 Ba(OH)2溶液中,水电离出的c(OH-)为10-12 mol?L-1 |
| D、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示,下列表述正确的( )


| A、pH=6时,C(H+)=C(SO32-)+C(OH-) |
| B、pH=2时,溶液中存在:C(Na+)>C(HSO3-)>C(H2SO3)>C(SO32-) |
| C、向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中会出现浑浊且pH值降为2,其离子方程式可表示为:Ca2++SO32-═CaSO3 |
| D、由图可知亚硫酸氢钠溶液呈酸性 |

 ),串联变阻器以调节电流,同时标出电极
),串联变阻器以调节电流,同时标出电极