题目内容
19.下列实验操作、现象和结论均正确的是( )| 选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有1mL浓硫酸的试管中加入5mL 0.1mol•L-1 的 K2Cr2O7溶液 | 溶液橙色变深 | 増大生成物浓度,平衡Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+逆向移 动 |
| B | 向Mg(OH)2悬浊液中加入少量 氯化铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg(OH)2+2NH4+?Mg2++2NH3•H2O具有可逆性 |
| C | 白铁皮(镀锌铁)出现刮痕后浸泡 在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液 | 无明显现象 | 该过程未发生原电池反应 |
| D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火 焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硫酸电离出氢离子,抑制平衡Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+,平衡逆向移动;
B.氯化铵可结合氢氧化镁电离出的氢氧根离子;
B.构成原电池时Zn为负极,Fe为正极;
D.C燃烧生成二氧化碳,能量变化与途径无关.
解答 解:A.硫酸电离出氢离子,抑制平衡Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+,平衡逆向移动,则溶液橙色变深,故A正确;
B.氯化铵可结合氢氧化镁电离出的氢氧根离子,发生Mg(OH)2+2NH4+?Mg2++2NH3•H2O,不能说明反应具有可逆性,故B错误;
B.构成原电池时Zn为负极,Fe为正极,结论不合理,故C错误;
D.C燃烧生成二氧化碳,能量变化与途径无关,则煤炭燃烧放出热量不变,结论不合理,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握平衡移动、原电池、反应中能量变化为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合,题目难度不大.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
9.检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是( )
| A. | NaOH | B. | KMnO4 | C. | KSCN | D. | 淀粉KI |
10.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 使酚酞变红色的溶液中:Na+、Na+、SO32-、NO3- | |
| C. | 能与金属铝反应生成氢气的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 无色透明的溶液中:K+、Cu2+、Cl-、NO3- |
7.按如图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )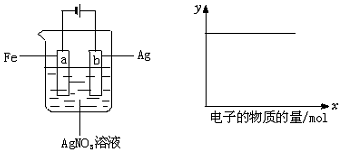
(1)c(Ag+) (2)c(NO3-) (3)a棒的质量 (4)b棒的质量 (5)溶液的pH.

(1)c(Ag+) (2)c(NO3-) (3)a棒的质量 (4)b棒的质量 (5)溶液的pH.
| A. | (1)(2) | B. | (3)(4) | C. | (1)(2)(4) | D. | (1)(2)(5) |
14.下列各图水槽中盛装的是海水,其中铁被腐蚀的最快的是( )
| A. |  | B. |  | C. |  | D. |  |
11. 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)?CO(g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2=+41.19 kJ•mol-1,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=$\frac{{K}_{1}}{{K}_{3}}$(用K1、K3表示).
(2)反应Ⅲ自发进行条件是较低温度(填“较低温度”、“较高温度”或“任何温度”).
(3)在一定条件下2L恒容密闭容器中充入3mol H2和1.5mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如表所示.
①T高于500℃(填“高于”或“低于”).
②温度为500℃时,该反应10min时达到平衡:
a.用H2表示该反应的速率为0.135mol•L-1•min-1;
b.该温度下,反应I的平衡常数K=200L2/mol2.
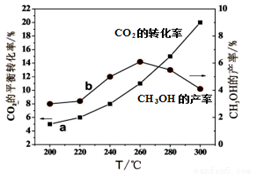
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示.
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是BD(选填编号).
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而增大(填“增大”、“减小”、“不变”或“无法判断”).
 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)?CO(g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2=+41.19 kJ•mol-1,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=$\frac{{K}_{1}}{{K}_{3}}$(用K1、K3表示).
(2)反应Ⅲ自发进行条件是较低温度(填“较低温度”、“较高温度”或“任何温度”).
(3)在一定条件下2L恒容密闭容器中充入3mol H2和1.5mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如表所示.
| 温度(℃) | 500 | T |
| CO2的平衡转化率 | 60% | 40% |
②温度为500℃时,该反应10min时达到平衡:
a.用H2表示该反应的速率为0.135mol•L-1•min-1;
b.该温度下,反应I的平衡常数K=200L2/mol2.
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示.
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是BD(选填编号).
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而增大(填“增大”、“减小”、“不变”或“无法判断”).
 实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题:
实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题: