题目内容
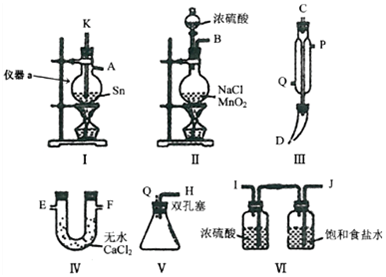
14.下列各图水槽中盛装的是海水,其中铁被腐蚀的最快的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A、没有形成原电池或电解质,属于正常的腐蚀;
B、铁与锌形成了原电池,铁做正极;
C、铁与锡形成原电池,铁做负极;
D、构成了电解池,铁做阴极.
解答 解:根据图知,B、C装置是原电池,D装置是电解池;
A、此装置没有形成原电池,属于钢铁的正常的腐蚀;
B、此装置铁作正极,锌易失电子而使铁受到保护,抑制铁腐蚀的速度;
C、装置中铁作负极,很容易失电子变成离子进入溶液,促进铁腐蚀的速度;
D、装置中铁作阴极,使铁受到保护,抑制铁腐蚀的速度;
综上分析,铁腐蚀最快的是C.
故选C.
点评 本题考查了金属的腐蚀与防护,难度不大,不同条件下金属腐蚀的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,并且原电池中,两极金属活泼性差越大,负极金属被腐蚀的速率越快.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列实验操作不能达到实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将洁净的铜丝在酒精灯外焰灼烧后慢慢移向内焰 | 验证铜可作为乙醇氧化为乙醛的催化剂 |
| B | 向饱和碳酸钠溶液中通入CO2 | 比较相同温度下碳酸钠和碳酸氢钠的溶解度 |
| C | 用锌片和稀硫酸制备H2时,滴加几滴Cu(NO3)2溶液 | 加快制备H2的反应速率 |
| D | 向5mL0.1mol•L-1KI溶液中滴入0.1mol•L-1FeCl3溶液5~6滴,加2mLCCl4振荡,静置后取上层清液滴加KSCN溶液,观察现象 | 验证Fe3+与I-的反应可逆 |
| A. | A | B. | B | C. | C | D. | D |
5.下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
| D | 胆矾 | 水蒸气 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 17g NH3所含的电子数是17NA | |
| B. | 32 g O3中含有氧原子的个数为2NA | |
| C. | 5.6gFe与足量盐酸完全反应,Fe失去的电子数为0.3NA | |
| D. | 标准状况下,11.2 LH2O中含有O-H键的数目为NA |
19.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有1mL浓硫酸的试管中加入5mL 0.1mol•L-1 的 K2Cr2O7溶液 | 溶液橙色变深 | 増大生成物浓度,平衡Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+逆向移 动 |
| B | 向Mg(OH)2悬浊液中加入少量 氯化铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg(OH)2+2NH4+?Mg2++2NH3•H2O具有可逆性 |
| C | 白铁皮(镀锌铁)出现刮痕后浸泡 在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液 | 无明显现象 | 该过程未发生原电池反应 |
| D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火 焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
| A. | A | B. | B | C. | C | D. | D |
6. 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
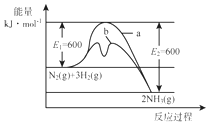
(1)根据图1提供的信息,写出该反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1.在图1中曲线b(填“a”或“b”)表示加入铁触媒的能量变化曲线.
(2)在恒容器中,下列描述中能说明上述反应已达平衡的是BDE.
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成nmolN2的同时生成2nmolNH3
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
E.断开一个氮氮键同时形成3个氢氢键
F.C(N2):C(H2):C(NH3)=1:3:2
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中NH3的体积分数$\frac{1}{9}$,则平均反应速率v(N2)=0.2mol/(L•min),该温度下的平衡常数K=$\frac{25}{432}$(用分数表示).如在该温度下向2L密闭容器中通入xmolN2、ymolH2、zmolNH3,使平衡向逆向移动,平衡后NH3的体积分数为573~637K时的反应时间、反应物配比等因素对其产率的影响.请完成以下实验设计表:
(4)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液可构成新型燃料电池,同时达到固氮作用.该电池的正极反应式为N2+6e-+8H+=2NH4+.
 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.(1)根据图1提供的信息,写出该反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1.在图1中曲线b(填“a”或“b”)表示加入铁触媒的能量变化曲线.
(2)在恒容器中,下列描述中能说明上述反应已达平衡的是BDE.
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成nmolN2的同时生成2nmolNH3
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
E.断开一个氮氮键同时形成3个氢氢键
F.C(N2):C(H2):C(NH3)=1:3:2
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中NH3的体积分数$\frac{1}{9}$,则平均反应速率v(N2)=0.2mol/(L•min),该温度下的平衡常数K=$\frac{25}{432}$(用分数表示).如在该温度下向2L密闭容器中通入xmolN2、ymolH2、zmolNH3,使平衡向逆向移动,平衡后NH3的体积分数为573~637K时的反应时间、反应物配比等因素对其产率的影响.请完成以下实验设计表:
| 编号 | 温度/K | 反应时间/h | 反应物质的量配比 | 实验目的 |
| ① | 573 | 4 | 1:3 | 实验②和④探究温度对产率的影响 |
| ② | 573 | 4 | 1:4 | |
| ③ | 573 | 3 | 4:1 | 实验②和③探究反应时间对 产率的影响 |
| ④ | 673 | 4 | 1:4 |
3.下列叙述正确的是( )
| A. | 23g乙醇含有碳氢键数为3NA | |
| B. | 标准状况下,2.24L SO3含有的分子数为0.1NA | |
| C. | 1mol 过氧化氢完全分解,电子转移数为1NA | |
| D. | 常温下,1L 0.5mol/L的FeCl3溶液中,所含Fe3+数为0.5NA |