题目内容
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 足量Mg与2.8gN2完全反应后失去0.2NA电子 | |
| B. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| C. | 常温常压下,2.8gC2H4含有共用电子对的数目为0.6NA | |
| D. | 16gO2含有NA个18O原子 |
分析 A.镁与氮气反应生成氮化镁,氮元素化合价从0价降为-3价,镁足量依据氮气计算转移电子数;
B.葡萄糖和冰醋酸最简式相同为CH2O,只需要计算3.0gCH2O的物质的量计算原子数;
C.求出乙烯的物质的量,然后根据1mol乙烯中含6mol共用电子对来分析;
D.O2中含有16O,不含18O.
解答 解:A.2.8gN2物质的量为$\frac{2.8g}{14gmol}$=0.2mol,与足量镁全反应后生成0.4mol-3价氮离子,转移电子数为1.2NA,故A错误;
B.葡萄糖和冰醋酸最简式相同为CH2O,只需要计算3.0gCH2O的物质的量计算原子数=$\frac{3.0g}{30g/mol}$×4×NA=0.4NA,故B错误;
C.2.8g乙烯的物质的量为0.1mol,而1mol乙烯中含6mol共用电子对,故0.1mol乙烯中含0.6NA对共用电子对,故C正确;
D.O2中含有16O,不含18O,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算及应用,明确以物质的量为核心计算公式,熟悉相关物质的结构组成是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.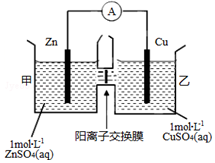 锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )
锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )
 锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )
锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )| A. | 铜电极上发生氧化反应 | |
| B. | 外电路中电子由Cu流向Zn | |
| C. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| D. | 电池工作一段时间后,甲池的C(SO42-)增大 |
19.下列叙述中,不能说明醋酸是弱电解质的是( )
| A. | CH3COONa溶液显碱性 | |
| B. | CH3COOH能与氨水发生中和反应 | |
| C. | 室温下,0.1mol/L的CH3COOH溶液的PH为3 | |
| D. | 相同条件下,等浓度的醋酸溶液的导电能力比盐酸弱 |
16.下列各叙述中不正确的是( )
| A. | 电解精炼铜时当阳极溶解32 g铜时,转移电子数大于NA个(Cu-64) | |
| B. | 向酸性FeSO4溶液中滴入少量NaClO溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| C. | 向10 mL 0.1mol•L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液20 mL,反应的离子方程式为:2Ba2++4OH-+NH4++Al3++2SO42-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 浓盐酸与KClO3混合受热制Cl2:6HCl+KClO3═3Cl2↑+3H2O+KCl,1molKClO3反应转移6 NA个电子 |
3.下列有关实验操作、现象及结论的叙述正确的是( )
| A. | 用钠可以检验某无水酒精中是否含有水 | |
| B. | 140℃时,无水乙醇与浓硫酸共热可制备乙烯 | |
| C. | 制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入浓硫酸,最后加入乙酸 | |
| D. | 在蔗糖溶液中加入少量稀硫酸,水浴加热后,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,没有砖红色沉淀生成,说明蔗糖没有水解 |
13.下列有关实验装置及实验方案的设计不正确的是( )
| 选项 | A | B | C | D |
| 实验装置 |  |  |  |  |
| 实验设计 | 探究SO2的氧化性和漂白性 | 实验室制氨气并收集干燥的氨气 | 验证苯中是否有碳碳双键 | 用乙醇提取溴水中的Br2 |
| A. | A | B. | B | C. | C | D. | D |
17.三盐(3PbO•PbSO4•H2O)可用作聚氯乙烯的热稳定剂,200℃以上开始失去结晶水,不溶于水及有机溶剂.以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示.
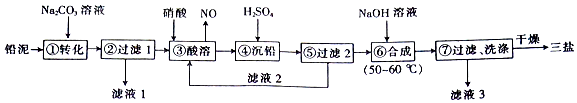
已知:PbSO4和PbCO3的溶解度和溶度积Ksp如表.
(1)步骤①转化的目的是将PbSO4转化为PbCO3,滤液1中的溶质为Na2CO3和Na2SO4(填化学式).
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是适当升温(或适当增大硝酸浓度或减小沉淀粒径等)(任写一条).其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O.
(3)滤液2中可循环利用的溶质的化学式为HNO3.若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=1.00×10-3mol/L.
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全.
(5)步骤⑥合成三盐的化学方程式为4PbSO4+6NaOH$\frac{\underline{\;50~60℃\;}}{\;}$3PbO•PbSO4•H2O+3Na2SO4+2H2O,若得到纯净干燥的三盐99.Ot,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为51.75%.

已知:PbSO4和PbCO3的溶解度和溶度积Ksp如表.
| 化合物 | PbSO4 | PbCO3 |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 |
| Ksp | 1.82×10-8 | 1.46×10-13 |
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是适当升温(或适当增大硝酸浓度或减小沉淀粒径等)(任写一条).其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O.
(3)滤液2中可循环利用的溶质的化学式为HNO3.若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=1.00×10-3mol/L.
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全.
(5)步骤⑥合成三盐的化学方程式为4PbSO4+6NaOH$\frac{\underline{\;50~60℃\;}}{\;}$3PbO•PbSO4•H2O+3Na2SO4+2H2O,若得到纯净干燥的三盐99.Ot,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为51.75%.
9.下列关于化学键的叙述正确的是( )
| A. | 全部由非金属元素组成的化合物中可含离子键 | |
| B. | H2O中所有原子都满足八电子稳定状态 | |
| C. | 两种元素构成的化合物可以含有非极性共价键 | |
| D. | CH4中所有的电子都参与形成共价键 |
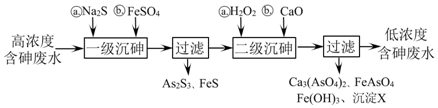
 ;②步骤2的离子方程式为12Ag++2H3As+3H2O═12Ag↓+As2O3+12H+;
;②步骤2的离子方程式为12Ag++2H3As+3H2O═12Ag↓+As2O3+12H+;