题目内容
10.X、Y、Z、W、R 的原子序数依次增大,X 单质在暗处与H 2剧烈化合并发生爆炸,Y 原子的最外层只有1个电子,Z 所处的周期序数与族序数相等,W 元素最高正价与最低负价绝对值相等,R 与 X同族,则( )| A. | 原子半径:Y>Z>X | |
| B. | X与R的核电荷数相差18 | |
| C. | 气态氢化物稳定性:W>R | |
| D. | Y与Z两者最高价氧化物对应的水化物能相互反应 |
分析 X、Y、Z、W、R 的原子序数依次增大,X 单质在暗处与H2剧烈化合并发生爆炸,则X是F元素;
Y 原子的最外层只有1个电子,且原子序数大于F元素,则Y是Na元素;
Z 所处的周期序数与族序数相等,为Al元素;
W 元素最高正价与最低负价绝对值相等,W为Si元素;
R与X同族,为Cl元素;
A.原子电子层数越多,其原子半径越大,同一周期元素原子半径随着原子序数增大而减小;
B.X与R的核电荷数相差8;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.Y、Z的最高价氧化物的水化物分别是NaOH、Al(OH)3,Al(OH)3属于两性氢氧化物,能溶于强酸、强碱溶液.
解答 解:X、Y、Z、W、R 的原子序数依次增大,X 单质在暗处与H2剧烈化合并发生爆炸,则X是F元素;
Y 原子的最外层只有1个电子,且原子序数大于F元素,则Y是Na元素;
Z 所处的周期序数与族序数相等,为Al元素;
W 元素最高正价与最低负价绝对值相等,W为Si元素;
R与X同族,为Cl元素;
A.原子电子层数越多,其原子半径越大,同一周期元素原子半径随着原子序数增大而减小,所以原子半径Y>Z>X,故A正确;
B.X的核电荷数是9、R的核电荷数是17,X与R的核电荷数相差8,故B错误;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性R>W,则氢化物的稳定性W<R,故C错误;
D.Y、Z的最高价氧化物的水化物分别是NaOH、Al(OH)3,Al(OH)3属于两性氢氧化物,能溶于强酸、强碱溶液,则Al(OH)3溶于强碱溶液生成偏铝酸钠和水,故D正确;
故选AD.
点评 本题考查原子结构和元素性质,为高频考点,侧重考查学生分析判断及知识综合运用能力,熟悉原子结构、周期表结构、元素周期律及元素化合物性质是解本题关键,注意氢氧化铝的两性,为易错点.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案| A. | 将NaHCO3、Na2SO3、FeCl3溶液蒸干灼烧均得不到原溶质 | |
| B. | 保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解 | |
| C. | 室温下,向0.1mol/L的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大 | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
| A. | 0.1mol铜粉在0.05mol氯气中充分燃烧,转移电子数为0.2NA | |
| B. | 常温常压下,22.4L氙气中含有NA个氙分子 | |
| C. | 一定量的浓H2SO4与0.1molMg恰好完全反应,生成SO2为0.1NA | |
| D. | 标准状况下,22.4L由SO2和O3组成的混合气体中含有3NA个原子 |
| A. | A溶液中的c(OH-)是B溶液中的c(OH-)的α1倍 | |
| B. | α1>α2 | |
| C. | B溶液的物质的量浓度可表示为$\frac{c}{{α}_{2}}$mol•L-1 | |
| D. | pH:溶液A>溶液B |
| A. | 标准状况下,11.2 L气体氘气(D2)中含有0.5NA个中子 | |
| B. | 1 L 0.1 mol•L-1醋酸溶液中含有0.1NA个氢离子 | |
| C. | 电解精炼铜时,若电路中转移0.2NA个电子,则阳极质量一定减少6.4 g | |
| D. | NO2和H2O反应每生成2 mol HNO3时被还原的NO2分子数为NA个 |
| A. | MgCl2 | B. | KCl | C. | NH4Cl | D. | H2SO4 |
 如图所示装置中,M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )
如图所示装置中,M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )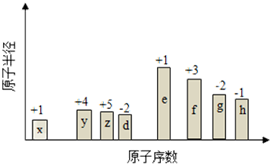 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题:
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题: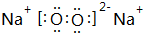 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.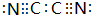 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.