题目内容
5.下列表达方式错误的是( )| A. | 甲烷的电子式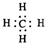 | |
| B. | 氟化钠的电子式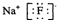 | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子 ${\;}_6^{12}$C |
分析 A.甲烷分子中含有4个碳氢键,碳原子最外层满足8电子稳定结构;
B.氟化钠为离子化合物,阴阳离子都需要标出所带电荷,氟离子还需要标出最外层电子;
C.硫离子核外电子总数为18,3p轨道含有6个电子;
D.元素符号的左上角为质量数、左下角为质子数.
解答 解:A.甲烷为正四面体结构,分子中含有4个碳氢键,其电子式为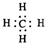 ,故A正确;
,故A正确;
B.氟化钠为离子化合物,钠离子直接用离子符号表示,氟离子需要标出所带电荷及最外层电子,氟化钠的电子式为 ,故B正确;
,故B正确;
C.硫原子得到2个电子变成硫离子,硫离子最外层满足8电子稳定结构,其正确的和我电子排布式为:硫离子的核外电子排布式:1s22s22p63s23p6,故C错误;
D.碳原子的质子数为6,碳-12原子的质量数为12,该原子可以表示为:${\;}_6^{12}$C,故D正确;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、和我电子排布式、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题侧重基础知识的考查,有利于提高学生的规范答题能力.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 食用白糖的主要成分是葡萄糖 | |
| B. | 淀粉溶液和蛋白质溶液都有丁达尔效应 | |
| C. | 油脂、淀粉和纤维素都是人体的重要营养物质 | |
| D. | 植物油的主要成分是高级脂肪酸 |
20.下列反应既是氧化还原反应,又是放热反应的是( )
| A. | 生石灰溶于水 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 铁与稀硫酸的反应 |
10.下列实验操作符合要求的是( )
| A. |  定容 | B. |  收集氨气 | ||
| C. |  高温煅烧石灰石 | D. |  除去氯气中的氯化氢 |
17.2011年8月12日,网上传云南曲靖市越州镇有总量5000余吨的重毒化工废料铬渣由于非法丢放,毒水被直接排放南盘江中.
某工厂对制革工业污泥中Cr(III)回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH如表:
(1)实验室用18.4mol•L-1的浓硫酸配制250mL 4.8mol•L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需250mL容量瓶、胶头滴管.
(2)酸浸时,为了提高浸取率可采取的措施是①升高反应温度,②搅拌,③过滤后再向滤渣中加入硫酸(多次浸取),④适当延长浸取时间(至少答一点).
(3)加入H2O2的作用是氧化+3价Cr使之转变成+6价Cr(或Cr2O72-),以便于与杂质离子分离.调节溶液的pH=8是为了除去Fe3+和Al3+离子.
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+.
(5)还原过程发生以下反应(请配平):
1Na2Cr2O7+3SO2+11H2O=2 Cr(OH)(H2O)5SO4+1Na2SO4.
某工厂对制革工业污泥中Cr(III)回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH如表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
(2)酸浸时,为了提高浸取率可采取的措施是①升高反应温度,②搅拌,③过滤后再向滤渣中加入硫酸(多次浸取),④适当延长浸取时间(至少答一点).
(3)加入H2O2的作用是氧化+3价Cr使之转变成+6价Cr(或Cr2O72-),以便于与杂质离子分离.调节溶液的pH=8是为了除去Fe3+和Al3+离子.
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+.
(5)还原过程发生以下反应(请配平):
1Na2Cr2O7+3SO2+11H2O=2 Cr(OH)(H2O)5SO4+1Na2SO4.
 实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有: