题目内容
14.有下列物质:①乙醇;②苯酚;③乙醛;④乙酸乙酯;⑤丙烯酸(CH2═CH-COOH).其中与溴水、KMnO4酸性溶液、NaHCO3溶液都能反应的是( )| A. | 仅①③ | B. | 仅②④ | C. | 仅⑤ | D. | 仅③⑤ |
分析 与溴水、KMnO4酸性溶液、NaHCO3溶液都能反应的有机物中一定含碳碳双键(或三键、-CHO)、-COOH,以此来解答.
解答 解:①乙醇与溴水不反应,故不选;
②苯酚与碳酸氢钠不反应,故不选;
③乙醛与碳酸氢钠不反应,故不选;
④乙酸乙酯与溴水、KMnO4酸性溶液、NaHCO3溶液都不能反应,故不选;
⑤丙烯酸(CH2═CH-COOH)中含碳碳双键,与溴水发生加成反应,与KMnO4酸性溶液发生氧化反应,含-COOH与NaHCO3溶液反应生成二氧化碳,故选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意烯烃、羧酸的性质,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
5.下列表达方式错误的是( )
| A. | 甲烷的电子式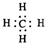 | |
| B. | 氟化钠的电子式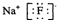 | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子 ${\;}_6^{12}$C |
2.将适量的铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,则关于滤出的固体和无色滤液的下列判断正确的是( )
| A. | 滤出的固体中一定含有银和铜,一定不含镁 | |
| B. | 滤出的固体中一定含有银,可能含有铜和镁 | |
| C. | 滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜 | |
| D. | 滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜 |
9. 某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:同温度下,Na2CO3比NaHCO3易溶于水.
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是bd(填字母序号).
a.溶液温度下降b.溶液温度升高c.滴入酚酞后呈浅红色d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
①两试管中均产生气体,Ⅰ(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是ac(填字母序号).
a.装置Ⅰ的气球体积较大b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5mol•L-1的溶液,设计如下方案并对反应现象做出预测:
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为Ca2++2HCO3-=CaCO3↓+CO2↑+H2O.
 某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:同温度下,Na2CO3比NaHCO3易溶于水.
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是bd(填字母序号).
a.溶液温度下降b.溶液温度升高c.滴入酚酞后呈浅红色d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
①两试管中均产生气体,Ⅰ(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是ac(填字母序号).
a.装置Ⅰ的气球体积较大b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5mol•L-1的溶液,设计如下方案并对反应现象做出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应::Ca2++CO32-=CaCO3↓(写离子方程式) |
| 操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
19.下列实验操作中错误的是( )
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 浓H2SO4稀释时,应将H2SO4慢慢加到H2O中,并及时搅拌和冷却 |
6.一定温度下,在一固定体积的密闭容器中,能说明可逆反应A(g)+3B(g)?2C(g)达到平衡状态的是( )
①C的生成速率与C的分解速率相等;
②单位时间内生成amolA,同时生成3amolB;
③气体密度不再变化;
④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为l:3:2;
⑥混合气体的平均相对分子质量不变.
①C的生成速率与C的分解速率相等;
②单位时间内生成amolA,同时生成3amolB;
③气体密度不再变化;
④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为l:3:2;
⑥混合气体的平均相对分子质量不变.
| A. | ②④⑤⑥ | B. | ①④⑥ | C. | ①②④⑥ | D. | ①③④⑤ |
3.不能正确表示下列反应的离子方程式是( )
| A. | Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑ | |
| B. | Na2O2溶于水产生O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀Ca2++HCO3ˉ+OHˉ=CaCO3↓+H2O | |
| D. | 饱和碳酸钠溶液中通入过量二氧化碳气体 CO32ˉ+CO2+H2O=2HCO3ˉ |
4.鉴别物质的方法错误的是( )
| A. | 用酚酞鉴别食盐水和稀醋酸 | B. | 用水鉴别生石灰和石灰石 | ||
| C. | 用燃着的木条鉴别空气和二氧化碳 | D. | 用氯化钡溶液鉴别稀盐酸和稀硫酸 |