题目内容
20.下列反应既是氧化还原反应,又是放热反应的是( )| A. | 生石灰溶于水 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 铁与稀硫酸的反应 |
分析 属于氧化还原反应说明该反应中有电子转移,其特征是有元素化合价升降,属于放热反应说明该反应中反应物总能量大于生成物总能量,常见的放热反应有:金属和酸的反应、中和反应、物质的燃烧、大多数化合反应等均,据此分析解答.
解答 解:A.生石灰溶于水生成氢氧化钙,该反应为放热反应,但是不属于氧化还原反应,故A错误;
B.Ba(OH)2•8H2O与NH4Cl 的反应属于吸热反应,且该反应中没有元素化合价变化,不属于氧化还原反应,故B错误;
C.反应C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO为氧化还原反应,但该反应是吸热反应,故C错误;
D.铁与稀硫酸的反应中Fe元素化合价由0价变为+2价,H元素化合价从+1变为0价,反应中存在化合价变化,属于氧化还原反应,且该反应还是放热反应,故D正确;
故选D.
点评 本题考查学生氧化还原反应的概念和常见的放热反应,根据是否有元素化合价的变化来判断,题目难度不大,注意熟记常见的放热反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 60g SiO2中含有NA个SiO2分子 | |
| B. | 标况下,22.4L SO3的分子数为NA | |
| C. | 1L 0.5 mol•L-1 CuCl2溶液中含有0.5NA个Cu2+ | |
| D. | 15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.2NA |
8.下列说法正确的是( )
| A. | 2,5-二甲基己烷的核磁氢谱中出现三组峰 | |
| B. | 丙烷分子的比例模型: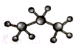 | |
| C. | 四氯化碳分子的电子式: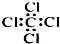 | |
| D. | 化合物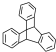 是苯的同系物 是苯的同系物 |
5.下列表达方式错误的是( )
| A. | 甲烷的电子式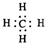 | |
| B. | 氟化钠的电子式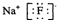 | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子 ${\;}_6^{12}$C |
12.下列关于化学键叙述正确的是( )
| A. | 化学键是相邻原子间的相互作用 | |
| B. | 化学键既存在于相邻原子之间,又存在与相邻分子之间 | |
| C. | 化学键通常指的是相邻的两个或多个原子之间的强烈互吸引作用 | |
| D. | 化学键通常是指物质中相邻的原子或离子之间存在的强烈相互作用 |
9. 某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:同温度下,Na2CO3比NaHCO3易溶于水.
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是bd(填字母序号).
a.溶液温度下降b.溶液温度升高c.滴入酚酞后呈浅红色d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
①两试管中均产生气体,Ⅰ(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是ac(填字母序号).
a.装置Ⅰ的气球体积较大b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5mol•L-1的溶液,设计如下方案并对反应现象做出预测:
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为Ca2++2HCO3-=CaCO3↓+CO2↑+H2O.
 某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:同温度下,Na2CO3比NaHCO3易溶于水.
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是bd(填字母序号).
a.溶液温度下降b.溶液温度升高c.滴入酚酞后呈浅红色d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
①两试管中均产生气体,Ⅰ(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是ac(填字母序号).
a.装置Ⅰ的气球体积较大b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5mol•L-1的溶液,设计如下方案并对反应现象做出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应::Ca2++CO32-=CaCO3↓(写离子方程式) |
| 操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
10.在下述条件下,一定能大量共存的离子组是( )
| A. | 无色透明的水溶液中:K+、Ba2+、I-、MnO4- | |
| B. | 能与Al反应产生H2的溶液中:HCO3-、Na+、Al3+、Br- | |
| C. | 澄清透明溶液中:K+、Fe3+、HCO3-、AlO2- | |
| D. | 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ |