题目内容
15.铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.(1)铁炭混合物在水溶液中可形成许多微电池.将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为Cr2O72-+14H++6e-=2Cr3++7H2O.
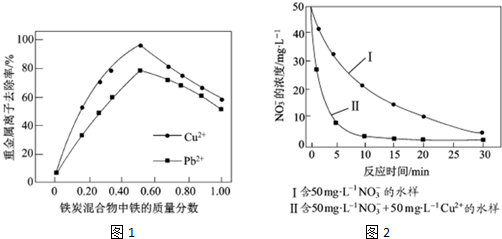
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图1所示.
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是活性炭对Cu2+和Pb2+有吸附作用.
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是铁的质量分数增加,铁炭混合物中微电池数目减少.
(3)纳米铁粉可用于处理地下水中的污染物.
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为2Fe2++BH4-+4OH-=2Fe+B(OH)4-+2H2↑.
②纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O
研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是纳米铁粉与H+反应生成H2.
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见图2),产生该差异的可能原因是Cu或Cu2+催化纳米铁粉去除NO3-的反应(或形成的Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率).
分析 (1)正极上Cr2O72-转化为Cr3+,发生还原反应,结合电荷守恒书写电极方程式;
(2)①当铁炭混合物中铁的质量分数为0时,则只有碳粉,碳粉具有吸附性,可去除水中少量的Cu2+和Pb2+;
②随着铁的质量分数的增加,形成的微电池数目减少,则Cu2+和Pb2+的去除率不升反降;
(3)①向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,反应中只有Fe、H元素化合价发生变化,结合质量守恒、电荷守恒可写出离子方程式;
②pH偏低,氢离子浓度偏大,则铁可与氢离子反应生成氢气;
③由图2可知铜离子浓度越大,去除率越大,铜离子可起到催化作用,也可能形成原电池反应.
解答 解:(1)正极上Cr2O72-转化为Cr3+,发生还原反应,在酸性溶液中,电极方程式为Cr2O72-+14H++6e-=2Cr3++7H2O,
故答案为:Cr2O72-+14H++6e-=2Cr3++7H2O;
(2)①当铁炭混合物中铁的质量分数为0时,则只有碳粉,可去除水中少量的Cu2+和Pb2+,原因是碳粉具有吸附性,也可起到净水的作用,
故答案为:活性炭对Cu2+和Pb2+具有吸附作用;
②随着铁的质量分数的增加,形成的微电池数目减少,反应速率减小,则Cu2+和Pb2+的去除率不升反降,
故答案为:铁的质量分数增加,铁炭混合物中微电池数目减少;
(3)①向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,反应中只有Fe、H元素化合价发生变化,发生氧化还原反应,离子方程式为2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-,
故答案为:2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-;
②pH偏低,氢离子浓度偏大,则铁可与氢离子反应生成氢气,可导致NO3-的去除率下降,故答案为:纳米铁粉与H+反应生成H2;
③由图2可知铜离子浓度越大,去除率越大,铜离子可起到催化作用,也可能形成原电池反应,
故答案为:Cu或Cu2+催化纳米铁粉去除NO3-的反应(或形成Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率).
点评 本题考查物质的分离、提纯,侧重于化学与生后、环境的考查,题目有利于培养学生的良好的科学素养,侧重于考查学生的分析、实验能力的考查,注意把握提给信息以及物质的性质,为解答该题的关键,难度中等.

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案| A. | 甲烷的电子式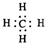 | |
| B. | 氟化钠的电子式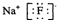 | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子 ${\;}_6^{12}$C |
①C的生成速率与C的分解速率相等;
②单位时间内生成amolA,同时生成3amolB;
③气体密度不再变化;
④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为l:3:2;
⑥混合气体的平均相对分子质量不变.
| A. | ②④⑤⑥ | B. | ①④⑥ | C. | ①②④⑥ | D. | ①③④⑤ |
| A. | Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑ | |
| B. | Na2O2溶于水产生O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀Ca2++HCO3ˉ+OHˉ=CaCO3↓+H2O | |
| D. | 饱和碳酸钠溶液中通入过量二氧化碳气体 CO32ˉ+CO2+H2O=2HCO3ˉ |
| A. | 无色透明的水溶液中:K+、Ba2+、I-、MnO4- | |
| B. | 能与Al反应产生H2的溶液中:HCO3-、Na+、Al3+、Br- | |
| C. | 澄清透明溶液中:K+、Fe3+、HCO3-、AlO2- | |
| D. | 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ |
| A. |  如图表示化学反应过程中释放能量 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 化学反应中一定存在化学键的变化 | |
| D. | 原电池是将化学能转变成电能的装置 |
| A. | 使湿润KI淀粉试纸变蓝色的气体一定是氯气 | |
| B. | 饱和氯水久置时Cl-增多、水分子减少 | |
| C. | 过量的铁在氯气中燃烧可生成氯化亚铁 | |
| D. | 可用pH试纸测定氯水的pH |
| A. | 用酚酞鉴别食盐水和稀醋酸 | B. | 用水鉴别生石灰和石灰石 | ||
| C. | 用燃着的木条鉴别空气和二氧化碳 | D. | 用氯化钡溶液鉴别稀盐酸和稀硫酸 |
| A. |  倾倒液体 | B. |  检查气密性 | ||
| C. |  收集二氧化碳气体 | D. |  滴加少量液体 |