题目内容
下列图示与对应的叙述相符的是( )
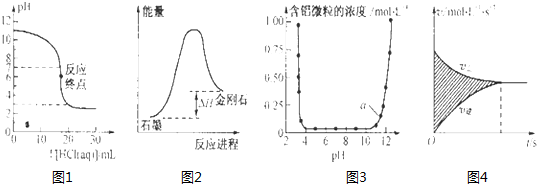

| A、图1表示0.001mol?L-1盐酸滴定0.001mol?L-1NaOH溶液的滴定曲线 |
| B、图2所示,从能量角度考虑,石墨比金刚石稳定 |
| C、图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存Al3+ |
| D、图4所示,图中的阴影部分面积的含义是[v(正)-v (逆)] |
考点:中和滴定,化学反应的能量变化规律,化学平衡建立的过程,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:A、反应终点的pH应为7;
B、物质的能量越低越稳定;
C、a点所示pH接近12,碱性环境中铝离子会生成氢氧化铝沉淀;
D、图中阴影部分的面积为[c(反应物)-c (生成物)].
B、物质的能量越低越稳定;
C、a点所示pH接近12,碱性环境中铝离子会生成氢氧化铝沉淀;
D、图中阴影部分的面积为[c(反应物)-c (生成物)].
解答:
解:A、反应终点的pH应为7不为6,故A错误;
B、从图上可知,石墨能量比金刚石低,石墨稳定,故B正确;
C、a点所示pH接近12,碱性环境中铝离子会生成氢氧化铝沉淀,故C错误;
D、图中阴影部分的面积为[c(反应物)-c (生成物)],故D错误;
故选B.
B、从图上可知,石墨能量比金刚石低,石墨稳定,故B正确;
C、a点所示pH接近12,碱性环境中铝离子会生成氢氧化铝沉淀,故C错误;
D、图中阴影部分的面积为[c(反应物)-c (生成物)],故D错误;
故选B.
点评:本题考查了据图分析中和滴定中的pH变化、物质的能量越低越稳定、铝离子的存在、正逆反应速率变化图线及含义,题目难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
25℃某浓度的盐酸、氯化铵溶液中水电离出的氢离子浓度分别为1.0×10-amol?L-1、1.0×10-bmol?L-1,则这两种溶液的pH之和为( )
| A、14-a+b |
| B、14+a+b |
| C、14-a-b |
| D、14+a-b |
下列比较中,正确的是( )
| A、等温等物质的量浓度溶液中,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大 |
| B、0.2 mol/L NH4Cl溶液和0.1 mol/LNaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| D、同浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3?H2O,c(NH4+)由大到小的顺序是①>②>③>④ |
 在陕西省高新技术开发区的应用材料公司、三星企业、光伏产业、光纤产业中,硅都发挥着重要的作用,请回答下列问题:
在陕西省高新技术开发区的应用材料公司、三星企业、光伏产业、光纤产业中,硅都发挥着重要的作用,请回答下列问题:

 前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对.
前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对.