题目内容
硫代硫酸钠溶液与盐酸的反应(Na2S2O3+2HCl═2NaCl+S+SO2+H2O ),可用于探究浓度对于反应速率的影响.常温常压下,若该反应产生固体单质16g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
( )
( )
| 二氧化硫 | 硫代硫酸钠 | 转移的电子 | |
| A | 1mol | NA | |
| B | 11.2L | 0.5mol | |
| C | 158g | 2mol | |
| D | 79g | 1NA |
| A、A | B、B | C、C | D、D |
考点:化学方程式的有关计算
专题:计算题
分析:硫代硫酸钠与稀盐酸反应Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O,Na2S2O3中硫元素的价态显+2价,发生氧化还原反应,从+2价硫变化为产物中的0、+4价硫,在反应中每消耗1molNa2S2O3转移2mol电子,生成1molS和1molSO2,据此即可解答.
解答:
解:硫代硫酸钠与稀盐酸反应Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O,根据题干中的信息,常温常压下,若该反应产生固体单质16g,则该固体为S,根据n=
,生成的硫的物质的量为n=
=0.5mol,需消耗0.5molNa2S2O3,生成0.5molSO2,转移1mol电子,转移NA电子,
A.生成0.5molS,同时生成0.5molSO2,转移1mol电子,转移NA电子,故A错误;
B.生成0.5molS,同时生成0.5molSO2,常温常压下,温度比标准状况高,所以体积比11.2L大,故B错误;
C.硫代硫酸钠的摩尔质量是158g/mol,158g硫代硫酸钠n=
=1mol,1molNa2S2O3在反应中转移2mol电子,而与题干中生成0.5molS需消耗0.5molNa2S2O3,生成0.5molSO2,转移1mol电子相矛盾,故C错误;
D.硫代硫酸钠的摩尔质量是158g/mol,79g硫代硫酸钠的物质的量为0.5mol,消耗0.5molNa2S2O3,生成0.5molSO2,转移1mol电子,转移NA电子,与题干中信息一致,故D正确;
故选D.
| m |
| M |
| 16g |
| 32g/mol |
A.生成0.5molS,同时生成0.5molSO2,转移1mol电子,转移NA电子,故A错误;
B.生成0.5molS,同时生成0.5molSO2,常温常压下,温度比标准状况高,所以体积比11.2L大,故B错误;
C.硫代硫酸钠的摩尔质量是158g/mol,158g硫代硫酸钠n=
| 158g |
| 158g/mol |
D.硫代硫酸钠的摩尔质量是158g/mol,79g硫代硫酸钠的物质的量为0.5mol,消耗0.5molNa2S2O3,生成0.5molSO2,转移1mol电子,转移NA电子,与题干中信息一致,故D正确;
故选D.
点评:本题考查氧化还原反应的计算,注意电子转移的数目与含硫化合物之间的关系是解答本题的关键,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
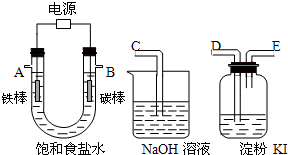
用四氯化碳萃取碘水中的碘,下列说法中不正确的是( )
| A、实验中使用的主要仪器是分液漏斗 |
| B、碘在四氯化碳中的溶解度比在水中的溶解度大 |
| C、不可把萃取剂四氯化碳换成酒精 |
| D、分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从分液漏斗上口倒出 |
下列叙述中正确的是( )
| A、可用托盘天平准确称取3.15gNaCl |
| B、实验室中可用燃烧法处理CO、H2、H2S等可燃性尾气 |
| C、测定中和热时,环形玻璃搅拌棒可用铜丝代替或直接用温度计搅拌 |
| D、Fe2+与Fe[(CN)6]3-反应生成Fe3[Fe(CN)6]2蓝色沉淀,该反应可用于Fe2+的检验 |
下列说法正确的是( )
| A、水泥、玻璃、陶瓷都是硅酸盐产品,均属于无机非金属材料 |
| B、明矾、漂白粉、臭氧都可作净水剂,其净水原理相同 |
| C、蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
| D、绿色化学的核心是应用化学原理对环境污染进行治理 |
能正确表示下列反应的离子方程式为( )
| A、向明矾溶液中加入足量的氢氧化钡溶液Ba2++4OH-+Al3++SO42-=BaSO4↓+AlO2-+2H2O |
| B、酸性高锰酸钾溶液与草酸溶液混合2MnO4-+5C2O42-+16H+=2Mn2++10 CO2↑+8H2O |
| C、将等物质的量浓度的氯水与FeI2溶液混合2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl- |
| D、向氢氧化钡溶液中通入足量的SO2气体OH-+SO2=HSO3- |

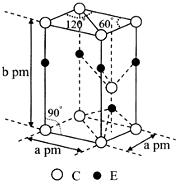 前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对.
前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对.