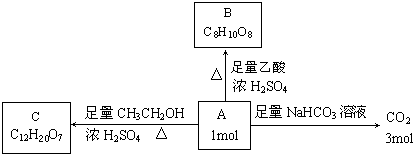
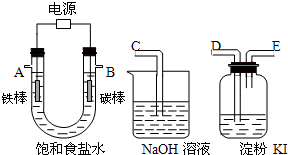
题目内容
在一定条件下,在密闭容器中发生合成氨反应,N2、H2、NH3的起始浓度分别为c1、c2、c3(均不为0).当反应达到平衡时,它们的浓度分别为0.1mol?L-1、0.3mol?L-1、0.08mol?L-1.下列判断错误的是( )
| A、当H2与NH3生成速率为3:2时,反应一定达到平衡状态 |
| B、H2与N2的转化率一定相等 |
| C、c1一定等于0.14mol?L-1 |
| D、c3的取值范围为:0<c3<0.28mol?L-1 |
考点:化学平衡的计算
专题:
分析:A、反应速率之比等于化学方程式计量数之比,氢气生成速率和消耗速率相同,反应达到平衡;
B、反应物的转化率和反应物的初始浓度以及变化浓度有关系;
C、c1一定等于0.14mol/L,是极值转化后氮气的浓度,实质是加入的氮气、氢气和氨气,氮气浓度不是0.14mol/L;
D、依据极值法计算分析;
B、反应物的转化率和反应物的初始浓度以及变化浓度有关系;
C、c1一定等于0.14mol/L,是极值转化后氮气的浓度,实质是加入的氮气、氢气和氨气,氮气浓度不是0.14mol/L;
D、依据极值法计算分析;
解答:
解:当反应达到平衡时,它们的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,采取极值转化分析判断
N2(g)+3H2(g)=2NH3(g)
平衡浓度 0.1 0.3 0.08
逆向极值转化 0.14 0.42 0
正向极值转化 0 0 0.28
A.当H2与NH3生成速率为3:2时,说明对氢气或氨气正逆反应速率相同,反应一定达到平衡状态,故A正确;
B.氮气和氢气平衡浓度之比为1;3,所以起始浓度一定按照1:3,所以H2与N2的转化率一定相等,故B正确;
C.如果c1一定等于0.14mol/L,那么反应应该是正向进行,而题中已知反应不一定是正方向进行,答案给的0.14是按照如果NH3的起始量为零的情况下正方向进行才会是0.14,因为转化量之比等于系数比,又由题知起始量不为零,故C错误;
D.按照极限法来算,如果正反应方向进行的,生成0.08mol,那么极限值NH3的起始量为零,如果逆反应方向进行那么生成0.1mol的N2和0.3mol的H2那么极限值的NH3起始量为0.28,又由题中条件告诉起始量不为零所以氨气的起始量应该介于0-0.28之间,c3的取值范围为0<c3<0.28mol/L,故D正确;
故选:C;
N2(g)+3H2(g)=2NH3(g)
平衡浓度 0.1 0.3 0.08
逆向极值转化 0.14 0.42 0
正向极值转化 0 0 0.28
A.当H2与NH3生成速率为3:2时,说明对氢气或氨气正逆反应速率相同,反应一定达到平衡状态,故A正确;
B.氮气和氢气平衡浓度之比为1;3,所以起始浓度一定按照1:3,所以H2与N2的转化率一定相等,故B正确;
C.如果c1一定等于0.14mol/L,那么反应应该是正向进行,而题中已知反应不一定是正方向进行,答案给的0.14是按照如果NH3的起始量为零的情况下正方向进行才会是0.14,因为转化量之比等于系数比,又由题知起始量不为零,故C错误;
D.按照极限法来算,如果正反应方向进行的,生成0.08mol,那么极限值NH3的起始量为零,如果逆反应方向进行那么生成0.1mol的N2和0.3mol的H2那么极限值的NH3起始量为0.28,又由题中条件告诉起始量不为零所以氨气的起始量应该介于0-0.28之间,c3的取值范围为0<c3<0.28mol/L,故D正确;
故选:C;
点评:本题考查了化学平衡影响因素、平衡常数计算、平衡标志判断的理解应用,注意平衡中极值方法的计算应用是解题关键,题目难度中等.

练习册系列答案
相关题目
下列哪种燃料直接燃烧对环境污染最严重( )
| A、煤 | B、柴油 | C、天然气 | D、酒精 |
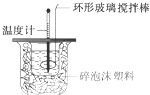 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.
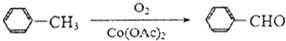
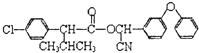 );
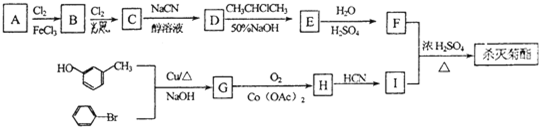
);
 在陕西省高新技术开发区的应用材料公司、三星企业、光伏产业、光纤产业中,硅都发挥着重要的作用,请回答下列问题:
在陕西省高新技术开发区的应用材料公司、三星企业、光伏产业、光纤产业中,硅都发挥着重要的作用,请回答下列问题: