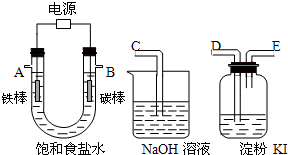
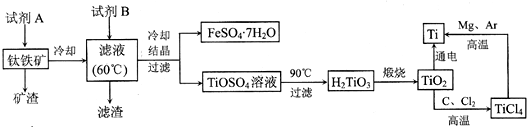
题目内容
常温下,向100mL 0.50mol/L的稀硫酸中滴入900mL BaCl2溶液后刚好反应完全.(假设混合溶液的体积为二者之和)
(1)BaCl2溶液的物质的量浓度为: ;混合溶液的pH= .
(2)如果向原稀硫酸中滴加0.10mol/L的NaOH溶液后,混合溶液的pH值与上述混合溶液相同,则该NaOH溶液的体积为 .
(1)BaCl2溶液的物质的量浓度为:
(2)如果向原稀硫酸中滴加0.10mol/L的NaOH溶液后,混合溶液的pH值与上述混合溶液相同,则该NaOH溶液的体积为
考点:pH的简单计算
专题:
分析:(1)n(H2SO4)=0.1L×0.50mol/L=0.05mol,向100mL 0.50mol/L的稀硫酸中滴入900mL BaCl2溶液后刚好反应完全,发生H2SO4+BaCl2=BaSO4↓+2HCl,反应前后氢离子物质的量不变,以此计算pH;
(2)如果向原稀硫酸中滴加0.10mol/L的NaOH溶液后,混合溶液的pH值与上述混合溶液相同,可计算反应后剩余的氢离子,结合溶液体积计算.
(2)如果向原稀硫酸中滴加0.10mol/L的NaOH溶液后,混合溶液的pH值与上述混合溶液相同,可计算反应后剩余的氢离子,结合溶液体积计算.
解答:
解:(1)n(H2SO4)=0.1L×0.50mol/L=0.05mol,向100mL 0.50mol/L的稀硫酸中滴入900mL BaCl2溶液后刚好反应完全,发生H2SO4+BaCl2=BaSO4↓+2HCl,
则有n(BaCl2)=n(H2SO4)=0.05mol,c(BaCl2)=
=0.056 mol/L,
c(H+)=
=0.1mol/L,pH=1,
故答案为:0.056 mol/L;1;
(2)设加入NaOH溶液的体积为VL,
则
=0.1mol/L,
V=0.45L=450mL,
故答案为:450mL.
则有n(BaCl2)=n(H2SO4)=0.05mol,c(BaCl2)=
| 0.05mol |
| 0.9L |
c(H+)=
| 0.05mol×2 |
| 1L |
故答案为:0.056 mol/L;1;
(2)设加入NaOH溶液的体积为VL,
则
| 0.05mol×2-0.1mol/L×VL |
| 0.1L+VL |
V=0.45L=450mL,
故答案为:450mL.
点评:本题考查了有关物质的量浓度的计算,题目难度不大,试题侧重基础知识的考查,注意掌握物质的量浓度的概念及表达式,明确电荷守恒在化学计算中的应用,试题有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
25℃某浓度的盐酸、氯化铵溶液中水电离出的氢离子浓度分别为1.0×10-amol?L-1、1.0×10-bmol?L-1,则这两种溶液的pH之和为( )
| A、14-a+b |
| B、14+a+b |
| C、14-a-b |
| D、14+a-b |
铜与人体分泌物中的盐酸以及空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)即是一种弱酸也是一种自由基,具有极高的活性.下列说法或表示正确的是( )
| A、氧化产物是HO2 |
| B、HO2在碱中能稳定存在 |
| C、氧化剂是O2 |
| D、1 mol Cu参加反应有2 mol电子发生转移 |
下列叙述中正确的是( )
| A、可用托盘天平准确称取3.15gNaCl |
| B、实验室中可用燃烧法处理CO、H2、H2S等可燃性尾气 |
| C、测定中和热时,环形玻璃搅拌棒可用铜丝代替或直接用温度计搅拌 |
| D、Fe2+与Fe[(CN)6]3-反应生成Fe3[Fe(CN)6]2蓝色沉淀,该反应可用于Fe2+的检验 |
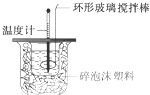 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.