题目内容
2.废旧印刷电路板的回收利用可实现资源再生,并减少污染,废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是BD(填字母).
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=64.39KJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46KJ•mol-1
H2(g)+$\frac{1}{2}{O_2}$(g)═H2O(l)△H=-285.84KJ•mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1.
(3)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ.又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式4Al(s)+3CO2(g)=3C(s)+2Al2O3(s)△H=(3a-4b)KJ/mol.
分析 (1)根据环境保护时不会产生污染环境的因素来判断;
(2)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式;
(3)依据在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ和盖斯定律计算得到所需热化学方程式.
解答 解:(1)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,
故答案为:BD;
(2)由①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H1=64.39KJ•mol-1;
②2H2O2(l)═2H2O(l)+O2(g)H2=-196.46KJ•mol-1;
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)H3=-285.84KJ•mol-1;
则反应Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)可由反应①+②×$\frac{1}{2}$+③得到,
由盖斯定律可知该反应的反应热△H=H1+H2×$\frac{1}{2}$+H3=64.39KJ•mol-1+(-196.46KJ•mol-1)×$\frac{1}{2}$+(-285.84KJ•mol-1)=-319.68KJ.mol-1,
故答案为:Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1.
(3)由题意可写出热化学方程式:
①C(s)+O2(g)═CO2(g)△H=-a kJ•mol-1,
②4Al(s)+3O2(g)═2Al2O3(s)△H=-4b kJ•mol-1.
高温下铝置换碳的反应为:4Al+3CO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3C,
根据盖斯定律:②-①×3可得,4Al(s)+3CO2(g)=3C(s)+2Al2O3(s),△H=(3a-4b)KJ/mol;
故答案为:4Al(s)+3CO2(g)=3C(s)+2Al2O3(s)△H=(3a-4b)KJ/mol.
点评 本题以废旧印刷电路板的回收利用为载体,考查了热化学方程式等知识,为高频考点,注意把握盖斯定律的应用,题目难度不大.

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案| A. | 为提高反应速率,可换用98%的浓硫酸 | |
| B. | 在反应过程中,水的电离程度逐渐增大 | |
| C. | 在反应体系中加入硫酸钠溶液,反应速率不变 | |
| D. | 在反应体系中加入少量醋酸钠固体,反应速率变慢,生成氢气的量减少 |

(1)如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.
①该电化腐蚀的类型为吸氧腐蚀.
②图中A、B、C三点附近的区域内,腐蚀最严重的是B(填字母).
(2)已知Fe3+、Fe2+、Cu2+在溶液中沉淀的pH如下表:
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
(3)用废铁皮制取铁红(Fe2O3)的部分流程示意图如图2:
①向Fe(NO3)2溶液中加入稀盐酸,溶液颜色由浅绿色变为棕黄色,该反应的原理为3Fe2++4H++NO3-=3Fe2++NO↑+2H2O(用离子方程式表示).
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O═2Fe2O3•nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,结合流程写出该反应的化学方程式为4Fe+10HNO3═4Fe(NO3)2+NH4NO3+3H2O.
(4)某铁质容器材料为碳素钢,可盛装冷浓硫酸.取5.60g该材料放人15.0mL浓硫酸中加热,充分反应后得到溶液X并收集到气体Y.
①甲组通过实验确定了X中含有Fe3+,为检验X中是否还含有Fe2+,可另取X溶液加入BD(填序号).
A.KSCN溶液和氯水 B.K3[Fe(CN)6]溶液
C.NaOH溶液 D.酸性KMnO4溶液
②为分析气体Y中的成分,乙组将560mL(标准状况)气体Y通入足量溴水,然后向该溶液中加入足量BaCl2溶液,过滤、洗涤、干燥后,称得沉淀质量为2.33g.则气体Y通入足量溴水反应的离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,参加该反应的气体在Y中的体积分数为40%.
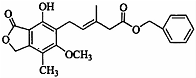
| A. | 分子中所有的原子共平面 | |
| B. | 既可以与FeCl3溶液发生显色反应.又可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 1 mol该化合物最多可以与9mol H2发生加成反应 | |
| D. | 该物质能发生取代反应、氧化反应、加成反应 |
| A. | NaCl溶液在电流作用下电离出自由移动的离子 | |
| B. | 设阿伏加德罗常数为NA,则2.24LCO2气体中所含原子数目为0.3NA | |
| C. | 实验室里将少量金属钠保存在煤油中 | |
| D. | 向某无色溶液中加入少量BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则此溶液中一定有SO42- |
 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、红褐色沉淀H,已知黄绿色气体乙为Cl2,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出),请根据以上信息回答下列问题:
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、红褐色沉淀H,已知黄绿色气体乙为Cl2,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出),请根据以上信息回答下列问题: