题目内容
11.常温下,0.05mol•L-1Ba(OH)2溶液的pH为( )| A. | 13 | B. | 1 | C. | 1.3 | D. | 12.7 |
分析 0.05mol/L的Ba(OH)2溶液中C(OH-)=2C[Ba(OH)2]=0.05mol/L×2=0.1mol/L,根据pH=-lgC(H+)=-lg$\frac{Kw}{c(O{H}^{-})}$计算溶液的pH.
解答 解:常温下,KW=1×10-14,氢氧化钡的电离:Ba(OH)2=Ba2++2OH-,所以0.05mol/L的Ba(OH)2溶液中C(OH-)=2C[Ba(OH)2]=0.05mol/L×2=0.1mol/L,根据pH=-lgC(H+)=-lg$\frac{Kw}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.1}$=13,故选A.
点评 本题考查了pH的简单计算,明确氢氧化钡与氢氧根离子浓度的关系是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
5.CPAE是蜂胶的主要活性成分,也可由咖啡酸合成
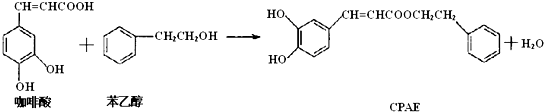
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 咖啡酸分子中所有原子不可能处在同一个平面上 | |
| B. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| C. | 1mol 苯乙醇在O2中完全燃烧,需消耗10molO2 | |
| D. | 1mol CPAE与足量的NaOH溶液反应,最多消耗3molNaOH |
6.下列有关热化学方程式正确的是( )
| 已知条件 | 热化学方程式 | |
| A | CH4的燃烧热(△H)为-890kJ• mol-1 | CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-890kJ• mol-1 |
| B | 中和热△H=-57.3kJ•mol-1 | CH3COOH(aq)+NaOH(aq)═H2O+CH3COONa (aq)△H=-57.3kJ•mol-1 |
| C | 一定条件下,0.5mol N2与1.5mol H2充分反应后放出30.5kJ的热量 | N2(g)+3H2(g)?2NH3(g)△H=-61kJ•mol-1 |
| D | 96g O2的能量比96g O3的能量低bkJ | 3O2(g)?2O3(g)△H=+bkJ• mol-1 |
| A. | A | B. | B | C. | C | D. | D |
3.以下物质间的每步转化通过一步反应就能实现的是( )
| A. | Al--Al2O3--Al(OH)3--Na[Al(OH)4] | B. | Mg--MgCl2--Mg(OH)2--MgO | ||
| C. | S--SO3--H2SO4--MgSO4 | D. | Si--SiO2--H2SiO3--Na2SiO3 |
6.下列对化学用语的理解正确的是( )
| A. | ${\;}_8^{18}$O表示中子数为8的氧原子 | B. | 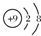 表示氟原子的结构示意图 表示氟原子的结构示意图 | ||
| C. | 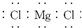 表示MgCl2的电子式 表示MgCl2的电子式 | D. | 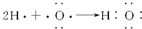 H表示H2O的形成过程 H表示H2O的形成过程 |
16.下列有机物不是同一种物质的是( )
| A. | 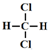 和 和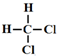 | B. | CH2=CH-CH=CH2和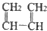 | ||
| C. | C(CH3)3C(CH3)3和CH3(CH2)3C(CH3)3 | D. | 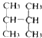 和 和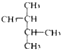 |
3.甲、乙、丙、丁四种物质之间的转化关系如图所示,则下列说法错误的是( ) 

| A. | 若甲是C,则乙可能是O2 | B. | 若甲是Fe,则乙可能是Cl2 | ||
| C. | 若甲是NaOH溶液,则乙可能是SO2 | D. | 若甲是H2S,则乙可能是O2 |
1.下列有关实验操作的说法错误的是( )
| A. | 中和滴定盛待测液的锥形瓶中有少量水对滴定结果无影响,锥形瓶不能用待测液润洗 | |
| B. | 酸式和碱式滴定管用蒸馏水洗净后还需用标准液或待测液润洗 | |
| C. | 滴定时左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视锥形瓶中颜色变化 | |
| D. | 滴定前仰视读数,滴定后平视刻度读数,被测待测溶液偏高 |
