题目内容
18.从矿物学资料查得,当胆矾溶液渗人地下,遇黄铁矿(FeS2)时可生成辉铜矿(Cu2S),同时还生成FeSO4和H2SO4,下列有关叙述中正确的是( )| A. | 在反应中,FeS2是氧化剂,不是还原剂 | |
| B. | 在反应中,CuSO4是氧化剂,FeS2是还原剂 | |
| C. | 反应中Cu2+与FeS2的物质的量之比是14:5 | |
| D. | 反应中每生成1mol Cu2S共得2mol电子 |
分析 该反应中Cu元素化合价由+2价变为+1价、S元素化合价由-1价变为+6价、-2价,Cu元素被还原、S元素被氧化和还原,反应方程式为:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,据此分析解答.
解答 解:A.该反应中Cu元素化合价由+2价变为+1价、S元素化合价由-1价变为+6价、-2价,所以FeS2既是氧化剂,又是还原剂,故A错误;
B.根据元素化合价知,部分FeS2和硫酸铜作氧化剂,故B错误;
C.由方程式可知,反应中Cu2+与FeS2的物质的量之比是14:5,故C正确;
D.该反应中Cu元素化合价由+2价变为+1价、S元素化合价由-1价变为-2价,则反应中每生成1mol Cu2S共得3mol电子,故D错误;
故选C.
点评 本题考查了氧化还原反应,根据元素化合价变化来分析解答即可,注意FeS2中S元素化合价,知道FeS2的作用,为易错点,题目难度中等.

练习册系列答案
相关题目
8.下列实验设计、操作或实验现象不合理的是( )
| A. | 取某试样溶液少量,加入KSCN溶液无明显现象,再滴入几滴氯水,若溶液显血红色,说明原试样中含Fe2+ | |
| B. | 淀粉溶液和稀硫酸共热后,加碱中和,再加少量银氨溶液水浴加热,有光亮的银镜生成 | |
| C. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸,再做银镜反应或与新制Cu(OH)2共热的实验 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共沸几分钟,然后加入足量稀硝酸,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
6.下列有关热化学方程式正确的是( )
| 已知条件 | 热化学方程式 | |
| A | CH4的燃烧热(△H)为-890kJ• mol-1 | CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-890kJ• mol-1 |
| B | 中和热△H=-57.3kJ•mol-1 | CH3COOH(aq)+NaOH(aq)═H2O+CH3COONa (aq)△H=-57.3kJ•mol-1 |
| C | 一定条件下,0.5mol N2与1.5mol H2充分反应后放出30.5kJ的热量 | N2(g)+3H2(g)?2NH3(g)△H=-61kJ•mol-1 |
| D | 96g O2的能量比96g O3的能量低bkJ | 3O2(g)?2O3(g)△H=+bkJ• mol-1 |
| A. | A | B. | B | C. | C | D. | D |
3.以下物质间的每步转化通过一步反应就能实现的是( )
| A. | Al--Al2O3--Al(OH)3--Na[Al(OH)4] | B. | Mg--MgCl2--Mg(OH)2--MgO | ||
| C. | S--SO3--H2SO4--MgSO4 | D. | Si--SiO2--H2SiO3--Na2SiO3 |
6.下列对化学用语的理解正确的是( )
| A. | ${\;}_8^{18}$O表示中子数为8的氧原子 | B. | 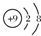 表示氟原子的结构示意图 表示氟原子的结构示意图 | ||
| C. | 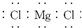 表示MgCl2的电子式 表示MgCl2的电子式 | D. | 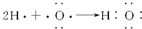 H表示H2O的形成过程 H表示H2O的形成过程 |
3.甲、乙、丙、丁四种物质之间的转化关系如图所示,则下列说法错误的是( ) 

| A. | 若甲是C,则乙可能是O2 | B. | 若甲是Fe,则乙可能是Cl2 | ||
| C. | 若甲是NaOH溶液,则乙可能是SO2 | D. | 若甲是H2S,则乙可能是O2 |
 .
.